
【題目】下表是某學生為探究AgCl沉淀轉化為![]() 沉淀的反應所做實驗的記錄.
沉淀的反應所做實驗的記錄.
步驟 | 現象 |
Ⅰ | 立即產生白色沉淀 |
Ⅱ | 沉淀迅速變為黑色 |
Ⅲ | 較長時間后,沉淀變為乳白色 |
Ⅳ | 產生紅棕色氣體,沉淀部分溶解 |
Ⅴ | 產生白色沉淀 |
![]() 為了證明沉淀變黑是AgCl轉化為
為了證明沉淀變黑是AgCl轉化為![]() 的緣故,步驟I中NaCl溶液的體積范圍為 ______ 。
的緣故,步驟I中NaCl溶液的體積范圍為 ______ 。
![]() 已知:
已知:![]() 時
時![]() ,
,![]() ,此沉淀轉化反應的平衡常數
,此沉淀轉化反應的平衡常數![]() ______。
______。
![]() 步驟V中產生的白色沉淀的化學式為 ______ ,步驟Ⅲ中乳白色沉淀除含有AgCl外,還含有 ______。
步驟V中產生的白色沉淀的化學式為 ______ ,步驟Ⅲ中乳白色沉淀除含有AgCl外,還含有 ______。
![]() 為了進一步確認步驟Ⅲ中乳白色沉淀產生的原因,設計了如下圖所示的對比實驗裝置。
為了進一步確認步驟Ⅲ中乳白色沉淀產生的原因,設計了如下圖所示的對比實驗裝置。
![]() 裝置A中玻璃儀器有圓底燒瓶、導管和 ______ ,試劑W為 ______ 。
裝置A中玻璃儀器有圓底燒瓶、導管和 ______ ,試劑W為 ______ 。
![]() 裝置C中的試劑為NaCl溶液和
裝置C中的試劑為NaCl溶液和![]() 懸濁液的混合物,B中試劑為 ______ 。
懸濁液的混合物,B中試劑為 ______ 。
![]() 實驗表明:C中沉淀逐漸變為乳白色,B中沒有明顯變化。
實驗表明:C中沉淀逐漸變為乳白色,B中沒有明顯變化。
完成C中反應的化學方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。

【答案】![]()
![]()
![]() S 分液漏斗 過氧化氫溶液
S 分液漏斗 過氧化氫溶液 ![]() 懸濁液
懸濁液 ![]() 氧氣將
氧氣將![]() 氧化成S時有
氧化成S時有![]() 產生,NaCl電離的氯離子與銀離子結合生成AgCl沉淀,使
產生,NaCl電離的氯離子與銀離子結合生成AgCl沉淀,使![]() 減小,有利于氧化還原反應的平衡右移
減小,有利于氧化還原反應的平衡右移
【解析】
(1)要證明沉淀變黑是AgCl轉化為![]() 的緣故,則步驟Ⅰ中必須使硝酸銀電離出的銀離子完全轉化成AgCl沉淀;
的緣故,則步驟Ⅰ中必須使硝酸銀電離出的銀離子完全轉化成AgCl沉淀;
(2) ;
;
(3)黑色的硫化銀沉淀被氧氣氧化為氯化銀沉淀和硫單質;硫單質被硝酸氧化為硫酸根離子;
(4) ①根據裝置圖判斷儀器名稱;裝置A的作用是提供氧氣;
②進一步確認步驟Ⅲ中乳白色沉淀產生的原因,裝置C中的試劑為NaCl溶液和![]() 懸濁液的混合物,則裝置B中應該不含氯化鈉溶液;
懸濁液的混合物,則裝置B中應該不含氯化鈉溶液;
③裝置C中生成的白色沉淀為氯化銀和S單質,反應物應該還有氧氣,產物中鈉離子只能以氫氧化鈉形式存在,則未知的反應物為氫氧化鈉,再根據H元素守恒可知另一種未知反應物為水,然后根據化合價升降相等配平反應方程式。
(1)要證明沉淀變黑是AgCl轉化為![]() 的緣故,則步驟Ⅰ中必須使硝酸銀電離出的銀離子完全轉化成AgCl沉淀,所以加入的NaCl溶液的體積必須
的緣故,則步驟Ⅰ中必須使硝酸銀電離出的銀離子完全轉化成AgCl沉淀,所以加入的NaCl溶液的體積必須![]() ;
;
(2)氯化銀轉化成硫化銀的反應為:![]() ,該反應的平衡常數為:
,該反應的平衡常數為: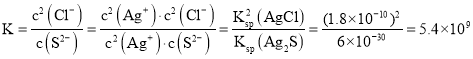 ;
;
(3)步驟Ⅲ中較長時間后,沉淀變為乳白色,則黑色的硫化銀沉淀氧化成氯化銀沉淀;再根據濾出Ⅲ中的乳白色沉淀,加入足量![]() 溶液,產生紅棕色氣體,沉淀部分溶解,則被氧化的只能為S元素,故乳白色沉淀為AgCl和S的混合物;其中S被稀硝酸氧化成硫酸根離子,則在步驟Ⅴ中向X中滴加
溶液,產生紅棕色氣體,沉淀部分溶解,則被氧化的只能為S元素,故乳白色沉淀為AgCl和S的混合物;其中S被稀硝酸氧化成硫酸根離子,則在步驟Ⅴ中向X中滴加![]() 溶液會生成
溶液會生成![]() 沉淀;
沉淀;
(4) ①根據圖示可知,裝置A中玻璃儀器有圓底燒瓶、導管和分液漏斗;乳白色沉淀為氯化銀和S的混合物,裝置A的作用是提供氧氣,根據圓底燒瓶中為二氧化錳可知W為過氧化氫溶液;
②進一步確認步驟Ⅲ中乳白色沉淀產生的原因,裝置C中的試劑為NaCl溶液和![]() 懸濁液的混合物,則裝置B中應該不含氯化鈉溶液,即為
懸濁液的混合物,則裝置B中應該不含氯化鈉溶液,即為![]() 懸濁液,通過對比反應現象判斷生成乳白色沉淀產生的原因;
懸濁液,通過對比反應現象判斷生成乳白色沉淀產生的原因;
![]() ;裝置C中氯化鈉的作用為:氧氣將
;裝置C中氯化鈉的作用為:氧氣將![]() 氧化成S時有
氧化成S時有![]() 產生,NaCl電離的氯離子與溶液中銀離子結合生成AgCl沉淀,使溶液中
產生,NaCl電離的氯離子與溶液中銀離子結合生成AgCl沉淀,使溶液中![]() 減小,從而有利于氧化還原反應
減小,從而有利于氧化還原反應![]() 向右移動。
向右移動。


科目:高中化學 來源: 題型:
【題目】2.0 mol PCl3和1.0 mol Cl2充入體積不變的密閉容器中,在一定條件下發生下述反應:
PCl3(g)+Cl2(g)![]() PCl5(g)達平衡時,PCl5為0.40 mol,如果此時再充入1.0 mol PCl3和0.50 mol Cl2,在相同溫度下再達平衡時PCl5的物質的量是( )
PCl5(g)達平衡時,PCl5為0.40 mol,如果此時再充入1.0 mol PCl3和0.50 mol Cl2,在相同溫度下再達平衡時PCl5的物質的量是( )
A.0.40 molB.0.60 mol
C.大于0.60 molD.大于0.40 mol,小于0.60 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】間苯二酚大環內酯具有較強的抗癌活性,其結構簡式如圖。下列有關間苯二酚大環內酯的說法不正確的是( )
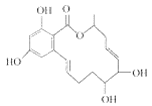
A.能使酸性KMnO4溶液褪色
B.能與FeCl3溶液發生顯色反應
C.能與濃溴水發生加成反應和取代反應
D.屬于油脂類化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是元素周期表的一部分,回答下列問題:
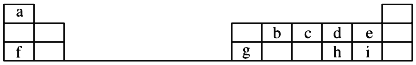
(1)元素e的負一價離子的結構示意圖為__________,f、g、h、i對應簡單離子的半徑由大到小的順序為____________________(用具體微粒符號表示)。
(2)元素i的單質溶于水,生成一種具有漂白作用的化合物,該化合物的電子式為____。
(3)b、c、d三種原子的得電子能力大小順為_____________________(用具體微粒符號表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】S16O2與18O2在高溫條件下發生反應2SO2+O2![]() 2SO3,達到化學平衡后,平衡混合物中含18O的微粒( )
2SO3,達到化學平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關同分異構體數目的判斷,正確的是
A.丁烷(C4H10)的二氯代物有10種
B.分子式為C4H8的烯烴包括順反異構體共5種
C.萘(![]() )環上一個氫原子被丁基(-C4H9)所取代的同分異構體(不考慮立體異構)有8種
)環上一個氫原子被丁基(-C4H9)所取代的同分異構體(不考慮立體異構)有8種
D.分子式為C5H12O的醇有4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,在容積為2L的密閉容器中,將2mol L氣體和3mol M氣體相混合,發生如下反應: 2L(g)+ 3M(g) ![]() xQ(g)+ 3 R(g),4s后該反應達到平衡時,生成2.4molR,并測得Q的反應速率為0.1mol/(L·s),下列有關敘述正確的是
xQ(g)+ 3 R(g),4s后該反應達到平衡時,生成2.4molR,并測得Q的反應速率為0.1mol/(L·s),下列有關敘述正確的是
A.x的值為2 B.混合氣體的密度變大
C.L的轉化率為80% D.平衡時M的濃度為0.6mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 在溫度不變時,水溶液中c(H+)和c(OH-)不能同時增大
B. pH=14的溶液是堿性最強的溶液
C. 中性溶液中必然有c(H+)=c(OH-)=1×10-7mol/L
D. 酸或堿溶液稀釋時,溶液的pH均減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F代表周期表中五種短周期元素,已知:
![]() 、B、C處于相鄰位置,B、C同周期,A、B同主族,其核外電子數之和為41。
、B、C處于相鄰位置,B、C同周期,A、B同主族,其核外電子數之和為41。
![]() 與C處于周期表中同一周期,
與C處于周期表中同一周期,![]() 中各層電子數都是
中各層電子數都是![]() 個。
個。
![]() 、B、C、D、E各元素最外層電子數之和24,且已知E與A只能形成一種化合物。
、B、C、D、E各元素最外層電子數之和24,且已知E與A只能形成一種化合物。
![]() 是半徑最小的原子。據此填空下列空白:
是半徑最小的原子。據此填空下列空白:
![]() 寫出各元素的名稱A ______ C ______ E ______
寫出各元素的名稱A ______ C ______ E ______
![]() 寫出A和D形成化合物的電子式 ______
寫出A和D形成化合物的電子式 ______
![]() 、C、D三種元素單原子離子的半徑由大到小的順序: ______
、C、D三種元素單原子離子的半徑由大到小的順序: ______
![]() 、B的氫化物的熔沸點大小并寫出原因: ______
、B的氫化物的熔沸點大小并寫出原因: ______
![]() 寫出A與B組成的化合物與C單質水溶液反應的化學方程式: ______ 。
寫出A與B組成的化合物與C單質水溶液反應的化學方程式: ______ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com