
| A. | 醋酸的電離方程式:CH3COOH→CH3COO一+H+ | |
| B. | 常溫下NH4Cl溶液的pH<7 | |
| C. | 因為SO3的水溶液能夠導電,所以SO3是強電解質 | |
| D. | 在常溫下的NaOH溶液中,由于NaOH抑制了水的電離,水的離子積常數(KW)減小 |
分析 A.醋酸在溶液中部分電離;
B.銨根離子水解溶液顯酸性;
C.SO3與水反應生成電解質;
D.水的離子積常數只與溫度有關.
解答 解:A.醋酸在溶液中部分電離,要用可逆號表達電離方程式,則醋酸的電離方程式:CH3COOH?CH3COO一+H+,故A錯誤;
B.銨根離子水解溶液顯酸性,所以常溫下NH4Cl溶液的pH<7,故B正確;
C.SO3與水反應生成電解質,所以SO3的水溶液能夠導電,但是SO3自身不能發生電離,所以SO3是非電解質,故C錯誤;
D.在常溫下的NaOH溶液中,由于NaOH抑制了水的電離,但是水的離子積常數只與溫度有關,所以KW的值不變,故D錯誤.
故選B.
點評 本題考查了弱電解質的電離、鹽的水解原理、電解質與非電解質、影響水的離子積的因素,題目涉及的知識點較多,側重于考查學生對基礎知識的綜合應用能力,題目難度不大.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH+HCl→NaCl+H2O | B. | 2NaOH+H2SO4→Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4→BaSO4↓+2H2O | D. | Ba(OH)2+2HCl→BaCl2+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
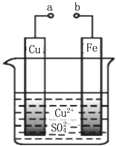
| A. | a和b不連接時,鐵片上有紅色的銅析出,該裝置不能形成原電池 | |
| B. | a和b用導線連接時銅片為負極,發生的反應為:Cu2++2e-═Cu | |
| C. | 無論a和b是否連接,鐵片均會被氧化,溶液中均有Fe2+生成 | |
| D. | a和b用導線連接時,溶液中的Cu2+應向銅電極移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有(1) | B. | 只有(3) | C. | (1)(2)(3)的混合物 | D. | (1)(2)(3)(4)的混合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能使pH試紙呈紅色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 10 mol•L-1的濃氨水:Al3+、NH4+、NO3-、I- | |
| C. | 與Al反應放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com