
【題目】二氧化氯(ClO2)是國際公認高效、安全的殺菌、保鮮劑,是氯制劑的理想替代品。工業上制備ClO2的方法很多,NaClO3 和NaClO2是制取ClO2的常見原料。完成下列填空:
(1)以下反應是制備ClO2的一種方法:H2C2O4+2NaClO3+H2SO4→Na2SO4+2CO2↑+2ClO2↑+2H2O
上述反應物中屬于第三周期元素的原子半徑大小順序是___;其中原子半徑最大元素的原子,其核外電子排布式為___,其核外有___種不同能量的電子。
(2)ClO2的分子構型為“V”形,則ClO2是___(選填“極性”、“非極性”)分子,其在水中的溶解度比氯氣___(選填“大”、“小”、“一樣”)。
(3)ClO2具有強氧化性,若ClO2和Cl2在消毒時自身均被還原為Cl-,ClO2的消毒能力是等質量Cl2的___倍(保留2位小數)。
(4)若以NaClO2為原料制取ClO2,需要加入具有___(填“氧化”、“還原”)性的物質。
(5)工業上制取NaClO3通過電解法進行,電解時,不同反應環境下的總反應分別為:
4NaCl +18H2O→4NaClO3+3O2↑+18H2↑(中性環境)
NaCl +3H2O→NaClO3 +3H2↑(微酸性環境)
①電解時,氫氣在___極產生。
②更有利于工業生產NaClO3的反應環境是___,理由__。
【答案】Na>S>Cl 1s22s22p63s1 4 極性 大 2.63 氧化性 陰極 微酸性環境 轉移電子都生成氯酸鈉,能量利用率高;水消耗少;不同時生成氫氣和氧氣,相對更安全
【解析】
(1)反應物中屬于第三周期的元素為Na、S、Cl,同周期元素從左到右原子半徑逐漸減小,原子半徑最大元素為Na,結合電子排布式1s22s22p63s1解答;
(2)ClO2分子構型為“V”形,正負電荷重心不重疊,為極性分子,易溶于水;
(3)1molCl2可以獲得2mol電子,1molClO2可以獲得電子5mol電子;
(4)以NaClO2為原料制取ClO2,Cl元素化合價由+3價升高到+4價;
(5)①電解時,氫氣由水還原生成;
②工業生產時,應注意安全問題。
(1)反應物中屬于第三周期的元素為Na、S、Cl,同周期元素從左到右原子半徑逐漸減小,則原子半徑大小順序為Na>S>Cl,原子半徑最大元素為Na,結合電子排布式1s22s22p63s1,同一軌道電子能量相同,則有四種能量不同的電子,故答案為:Na>S>Cl;1s22s22p63s1;4;
(2)ClO2分子構型為“V”形,正負電荷重心不重疊,為極性分子,易溶于水,其在水中的溶解度比氯氣大,故答案為:極性;大;
(3)設質量都是71g,氯氣得到的電子數為:![]() ,ClO2得到的電子數為:
,ClO2得到的電子數為:![]() ,則ClO2消毒的效率是Cl2的倍數為
,則ClO2消毒的效率是Cl2的倍數為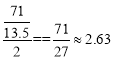 ,故答案為:2.63;
,故答案為:2.63;
(4)以NaClO2為原料制取ClO2,Cl元素化合價由+3價升高到+4價,應加入氧化劑,故答案為:氧化;
(5)①電解時,氫氣由水還原生成,則應在陰極生成,故答案為:陰;
②由電解方程式可知微酸性環境生成氣體為氫氣,而在中性環境中生成氧氣和氫氣,易導致爆炸的危險,且微酸性環境能量利用率高,水消耗少,在故答案為:微酸性環境;轉移電子都生成氯酸鈉,能量利用率高,水消耗少,不同時生成氫氣和氧氣,相對更安全。


科目:高中化學 來源: 題型:
【題目】對于平衡體系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0。下列結論中錯誤的是
pC(g)+qD(g) ΔH<0。下列結論中錯誤的是
A.若溫度不變,將容器的體積縮小到原來的一半,此時A的濃度為原來的2.1倍,則m+n<p+q
B.若平衡時,A、B的轉化率相等,說明反應開始時,A、B的物質的量之比為m∶n
C.若m+n=p+q,則往含有a mol氣體的平衡體系中再加入a mol的B,達到新平衡時,氣體的總物質的量等于2a
D.若溫度不變時壓強增大到原來的2倍,達到新平衡時,總體積一定比原來的![]() 要小
要小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】古代有火燒孔雀石煉銅(加入炭)和濕法煉銅(在溶液中加鐵),下列有關說法不正確的是( )
A. 火燒孔雀石煉銅發生的反應有Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
B. 火燒孔雀石煉銅發生的反應有2CuO+C![]() CO2↑+2Cu
CO2↑+2Cu
C. 濕法煉銅發生的主要反應為Fe+Cu2+===Cu+Fe2+
D. 兩種煉銅的方法涉及的主要反應都是氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗過程如圖所示:則圖③的試管中的現象是
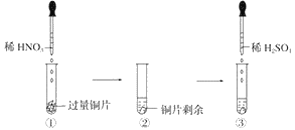
A. 無明顯現象,因稀硫酸不與銅反應
B. 銅片溶解,產生無色氣體,該氣體遇到空氣不變色
C. 銅片溶解,放出紅棕色有刺激性氣味的氣體
D. 銅片溶解,產生無色氣體,該氣體在試管口變為紅棕色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Be(OH)2是兩性的,跟強酸反應時生成Be2+,跟強堿反應時生成BeO22—。現有三份等物質的量濃度、等體積的BeCl2、MgCl2、AlCl3溶液(配制時均加入少量鹽酸),現將一定濃度的NaOH溶液分別滴入三種溶液中至過量,NaOH溶液的體積x(mL)與生成沉淀的物質的量y(mol)的關系如圖所示,則與BeCl2、MgCl2、AlCl3三種溶液對應的圖像正確的是( )

A. ⑤③① B. ②③④ C. ③⑤④ D. ③②①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某城市對大氣進行監測,發現該市首要污染物為可吸入顆粒物PM2.5(直徑小于等于2.5μm的懸浮顆粒物),其主要來源為燃煤、機動車尾氣等。因此,對PM2.5、SO2、NOx等進行研究具有重要意義。請回答下列問題:
(1)PM2.5分散在空氣中形成的分散系__(填“屬于”或“不屬于”)膠體。
(2)將PM2.5樣本用蒸餾水處理制成待測試樣。若測得該試樣所含水溶性無機離子的化學組分及其平均濃度如下表:
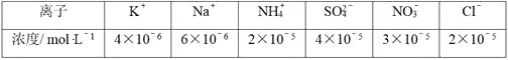
根據表中數據判斷待測試樣為__(填“酸”或“堿”)性,表示該試樣酸堿性的c(H+)或c(OH-)=__mol·L-1。
(3)煤燃燒排放的煙氣含有SO2和NOx,形成酸雨,污染大氣,采用NaClO2溶液在堿性條件下可對煙氣進行脫硫,脫硝,效果非常好。完成下列對煙氣脫硝過程的離子方程式。
__ClO2-+__NO+__=__Cl-+__NO3-+__
(4)為減少SO2的排放,常采取的措施有:
①將煤轉化為清潔氣體燃料。寫出焦炭與水蒸氣反應的化學方程式:__。
②洗滌含SO2的煙氣。以下物質可做洗滌劑的是__(填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽車尾氣中NOx和CO的生成及轉化。
①汽車啟動后,汽缸溫度越高,單位時間內NO排放量越大,寫出汽缸中生成NO的化學方程式:__。
②汽車燃油不完全燃燒時產生CO,目前,在汽車尾氣系統中裝置催化轉化器可減少CO和NO的污染,其化學反應方程式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將0.6mol KCl、0.4mol Cu(NO3)2、0.2molAgNO3一起溶于水,配成100mL混合溶液,用惰性電極電解一段時間后,若在一極析出19.2g Cu,此時在另一極上產生氣體的體積(標準狀況下)為
A.3.96LB.4.48LC.5.6LD.6.72L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨在人類的生產和生活中有著廣泛的應用,某化學興趣小組利用圖一裝置探究氨氣的有關性質。
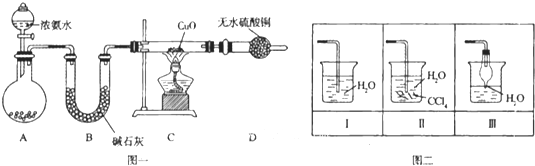
(1)裝置A中燒瓶內試劑可選用 (填序號)。B的作用是
a.堿石灰 b.濃硫酸 c.生石灰 d.燒堿溶液
(2)連接好裝置并檢驗裝置的氣密性后,裝入藥品,然后應先 (填I或Ⅱ).
Ⅰ.打開旋塞逐滴向圓底燒瓶中加入氨水 Ⅱ.加熱裝置C
(3)實驗中觀察到C中CuO粉末變紅,D中無水硫酸銅變藍,并收集到一種單質氣體,則該反應相關化學方程式為 ,.該反應證明氨氣具有 性.
(4)該實驗缺少尾氣吸收裝置,圖二中能用來吸收尾氣的裝置是 (填裝置序號).
(5)氨氣極易溶于水,若標準狀況下,將2.24L的氨氣溶于水配成0.5L溶液,所得溶液的物質的量濃度為 mol/L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應速率和限度與生產、生活密切相關。
(1)某學生為了探究鋅與鹽酸反應過程中的速率變化,在400 mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
時間/min | 1 | 2 | 3 | 4 | 5 |
氫氣體積/mL(標準狀況) | 100 | 240 | 464 | 576 | 620 |
①哪一時間段反應速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是_____。
②求3~4 min時間段以鹽酸的濃度變化來表示的該反應速率______(設溶液體積不變)。
(2)另一學生為控制反應速率防止反應過快難以測量氫氣體積,他事先在鹽酸中加入等體積的下列溶液以減慢反應速率,你認為不可行的是________(填字母)。
A.蒸餾水 B.KCl溶液
C. KNO3溶液D.Na2SO4溶液
(3)某溫度下在4 L密閉容器中,X、Y、Z三種氣態物質的物質的量隨時間變化曲線如圖。
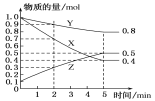
①該反應的化學方程式是_________。
②該反應達到平衡狀態的標志是____(填字母)。
A.Y的體積分數在混合氣體中保持不變
B.X、Y的反應速率比為3∶1
C.容器內氣體壓強保持不變
D.容器內氣體的總質量保持不變
E.生成1 mol Y的同時消耗2 mol Z
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com