
【題目】燃煤及工業廢氣中的SO2是形成酸雨的主要原因,消除SO2是減少酸雨形成的有效方法。完成下列問題:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
則2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)堿性NaClO2溶液脫硫法
SO2與堿性NaClO2溶液反應的離子方程式為2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在剛性容器中,將含SO2的廢氣通入堿性NaClO2溶液中,測得pc與溫度的關系如圖所示。
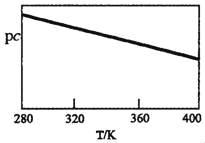
由圖分析可知,該脫硫反應是_____反應(填“放熱”或“吸熱”);若溫度不變,增大壓強,該脫硫反應的平衡常數K_____(填“增大”、“減小”或“不變”)。
(3)燃料細菌脫硫法
①含FeS2的燃煤可用氧化亞鐵硫桿菌(T.f)、氧化亞鐵微螺菌(L.f)、氧化硫硫桿菌(T.t)進行脫硫,其脫硫過程如圖所示:
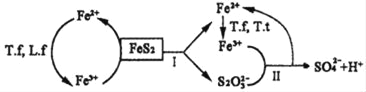
已知:脫硫總反應為:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反應的化學方程式為:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
寫出Ⅱ反應的化學方程式_____。
②在上述脫硫反應中,氧化亞鐵硫桿菌(T.f)與Fe3+的形成過程可視為下圖所示的原電池:

該細胞膜為_____(填“陽離子交換膜”或“陰離子交換膜”)。該電池的正極電極反應式為_____。該方法在高溫下脫硫效率大大降低,原因是_____。
【答案】﹣2062.5 放熱 不變 8Fe3++S2O32﹣+5H2O═2SO42﹣+8Fe2++10H+ 陽離子交換膜 O2+4H++4e﹣=2H2O 溫度過高蛋白質發生變性,細菌失去催化能力 。
【解析】
(1)蓋斯定律計算,利用同向相加、異向相減的原則;
(2)由圖分析可知,升溫平衡向吸熱方向移動可知,對于平衡常數,如果是放熱反應,隨著溫度上升,平衡常數減小;如果是吸熱反應,隨著溫度上升,平衡常數上升;溫度不變,K不變;
(3)①觀察圖像可知:反應Ⅱ是Fe3+和S2O32﹣反應生成亞鐵離子和硫酸根離子,利用得失電子數相等、電荷守恒、原子守恒寫出離子方程式;
②在脫硫反應中,氧化亞鐵硫桿菌(T.f)與Fe3+的形成過程為如圖所示的原電池反應,亞鐵離子被氧化發生氧化反應在原電池負極反應,正極是氧氣在酸性溶液中生成水,正極消耗氫離子,確定細胞膜為陽離子交換膜;溫度過高蛋白質發生變性,細菌失去催化能力;
(1)已知:①4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
②Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
③2C(s)+O2(g)=2CO(g)△H=﹣221.0 kJmol﹣1
蓋斯定律①×1/2+②+③×3/2計算 2FeS2(s)+7O2(g)+3C(s)=2Fe(s)+3CO2(g)+4SO2(g)△H=﹣2062.5KJ/mol;
答案:﹣2062.5。
(2)已知pc=﹣lgc(SO2),pc與溫度的關系分析,溫度越高Pc越小,則二氧化硫濃度增大,逆反應為吸熱反應,正反應為放熱反應,平衡常數只隨溫度變化,若溫度不變,增大壓強,該脫硫反應的平衡常數K不變;
答案:放熱;不變。
(3)①反應Ⅱ是Fe3+和S2O32﹣反應生成亞鐵離子和硫酸根離子,反應的離子方程式:8Fe3++S2O32﹣+5H2O═2SO42﹣+8Fe2++10H+;
答案:8Fe3++S2O32﹣+5H2O═2SO42﹣+8Fe2++10H+。
②脫硫反應中,氧化亞鐵硫桿菌(T.f)與Fe3+的形成過程為如圖所示的原電池反應,亞鐵離子被氧化發生氧化反應在原電池負極反應,正極是氧氣在酸性溶液中生成水,電極反應:O2+4H++4e﹣=2H2O,正極消耗氫離子,該細胞膜為陽離子交換膜,該方法在高溫下脫硫效率大大降低,原因是:溫度過高蛋白質發生變性,細菌失去催化能力;
答案:陽離子交換膜;O2+4H++4e﹣=2H2O;溫度過高蛋白質發生變性,細菌失去催化能力。


科目:高中化學 來源: 題型:
【題目】(1)據科技日報網報道,南開大學科研團隊借助鎳和苯基硼酸共催化劑,首次實現烯丙醇高效、綠色合成。烯丙醇及其化合物可制成甘油、醫藥、農藥、香料,合成維生素E和KI及天然抗癌藥物紫杉醇中都含有關鍵的烯丙醇結構。丙烯醇的結構簡式為CH2=CH-CH2OH。請回答下列問題:
①基態鎳原子的價電子排布式為___________________。
②1 mol CH2=CH-CH2OH含____molσ鍵,烯丙醇分子中碳原子的雜化類型為________。
③ Ni2+能形成多種配離子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,與CN-互為等電子體的分子為____________。
(2)乙炔是有機合成工業的一種原料。工業上曾用CaC2與水反應生成乙炔。
①CaC2中C22-與O22+互為等電子體,O22+的電子式可表示為_____________; lmol O22+中含有的π鍵數目為_______________。
②將乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2紅棕色沉淀。Cu+基態核外電子排布式為____________。
③乙炔與氫氰酸反應可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子軌道雜化類型是_______________;分子中處于同一直線上的原子數目最多為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在實驗室中用二氧化錳跟濃鹽酸反應制備干燥純凈的氯氣.進行此實驗,所用儀器如圖:
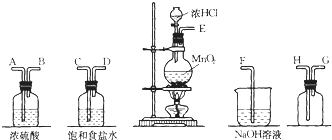
(1)連接上述儀器的正確順序是:E接__,__接__,__接__,__接F。
(2)氣體發生裝置中進行的反應化學方程式是__;當0.5molMnO2參與反應時,生成的Cl2在標準狀況下的體積約__。
(3)在裝置中:①飽和食鹽水的作用是__,②濃硫酸的作用是___。
(4)化學實驗中檢驗是否有Cl2產生常用濕潤的淀粉-KI試紙。如果有Cl2產生,可觀察到的現象是___。
(5)寫出尾氣吸收裝置中進行的反應的化學方程式__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.熔融NaCl能導電,是因為通電時NaCl發生了電離
B.NaCl固體不導電,因為NaCl固體中無帶電微粒
C.NH4NO3電離時產生了NH![]() 、NO
、NO![]() ,無金屬離子,所以NH4NO3不是鹽
,無金屬離子,所以NH4NO3不是鹽
D.NaHSO4在水溶液中電離生成了Na+、H+、SO![]() 三種離子
三種離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列反應:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O
針對上述兩個反應回答:
(1)用單線橋標出①中電子轉移的方向和數目_______________________________;
(2)寫出②的離子化學方程式_____________________________________________;
(3)Cl2、H2SO4和KMnO4的氧化性由強到弱的順序為________________________;
(4)反應②中氯化氫表現出的性質是________。
a.還原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知破壞1 mol A—A鍵、1 mol B—B鍵、1 mol A—B鍵時分別需要吸收436 kJ、498 kJ、463 kJ的能量。反應2A2+B2![]() 2A2B的能量變化關系如圖所示。下列說法中錯誤的是( )。
2A2B的能量變化關系如圖所示。下列說法中錯誤的是( )。
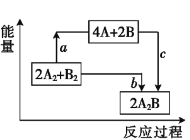
A. a=1370 kJB. b=482 kJ
C. 該反應是吸熱反應D. 體系中A、B原子最活潑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在中學化學中,KMnO4是常見的氧化劑之一。某實驗小組收集整理了相關知識:
(1) KMnO4中Mn的化合價為_______。
(2) 實驗室中可以加熱分解KMnO4制取O2,其反應方程式為_______________。
(3) 實驗中常在KMnO4溶液中加入適量稀硫酸,增加KMnO4的氧化性,但不宜用鹽酸酸化,因為濃度較大時,KMnO4可能將Cl-氧化成Cl2,該反應中氧化劑和還原劑的物質的量之比為:____________ ,比較以下兩種物質的氧化性:KMnO4_____________于Cl2(填“強”或“弱”)
(4) H2C2O4(草酸)是生物體的一種代謝產物,生活中常用作還原劑、除銹劑,將H2C2O4溶液滴入硫酸酸化的KMnO4溶液,當KMnO4被完全還原時,溶液顏色由_______變成無色,同時有無色氣體生成。該反應方程式為:_____________________。
(5)某同學將KMnO4溶液加入H2O2溶液,卻忘記了滴入稀硫酸,片刻后,有氣泡產生,且出現黑色沉淀。該沉淀化學式為____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃鐵礦(主要成分為FeS2)的利用對資源和環境具有重要意義。
(1)工業上煅燒黃鐵礦可制取SO2。已知下列熱化學方程式
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
則4Fe(s)+3O2(g)=2Fe2O3(s) △H=_____kJ/mol
(2)一種酸性條件下催化氧化黃鐵礦的物質轉化關系如圖I所示。
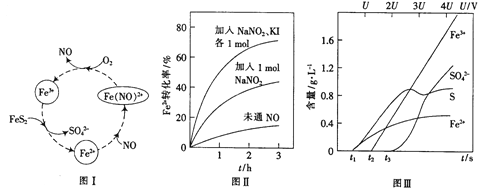
(1)寫出如圖中Fe3+與FeS2反應的離子方程式:______________。
(2)硝酸也可將FeS2氧化為Fe3+和SO42-,使用濃硝酸比使用稀硝酸反應速率慢,其原因是______________。
(3)控制Fe2+的濃度、溶液體積和通入O2的速率一定,圖II所示為改變其他條件時Fe2+被氧化的轉化率隨時間的變化。
① 加入NaNO2發生反應:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反應則轉移電子的數目為______mol。
② 加入NaNO2、KI發生反應:4H++2NO2-+2I-=2NO+I2+2H2O。解釋圖II中該條件下能進一步提高單位時間內Fe2+轉化率的原因:______________。
(4)為研究FeS2作電極時的放電規律,以FeS2作陽極進行電解,由FeS2放電產生粒子的含量與時間、電壓(U)的關系如圖III所示。
①寫出t1至t2間FeS2所發生的電極反應式:__________。
②當電壓的值介于3U~4U之間,FeS2放電所得主要粒子為___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com