
金屬鈦代替鋼鐵廣泛應用于宇宙火箭和導彈中,有“宇宙金屬”之稱。下列有關![]() 的說法中正確的是
的說法中正確的是
A.![]() 原子中均含22個中子
原子中均含22個中子
B.![]() 在周期表中位置相同,都在第4縱行
在周期表中位置相同,都在第4縱行
C.分別由![]() 組成的金屬鈦單質互稱為同分異構體
組成的金屬鈦單質互稱為同分異構體
D.![]() 為同一核素
為同一核素
 快樂小博士鞏固與提高系列答案
快樂小博士鞏固與提高系列答案科目:高中化學 來源: 題型:
| A(短周期) | B(短周期) | C | D(短周期) |
| 原子最外層上p電子數等于次外層電子數 | 原子最外層有兩個未成對電子,其單質為人類生存必須物質 | 單質為生活中常見的金屬材料,有紫紅色金屬光澤 | 單質是常見的半導體材料,廣泛應用于IT行業 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2012-2013學年四川成都棠湖中學外語實驗學校高二5月月考化學卷(帶解析) 題型:填空題
碳化硅(SiC) 、氧化鋁(Al2O3) 和氮化硅(Si3N4)是優良的高溫結構陶瓷,在工業生產和科技領域有重要用途。宇宙火箭和導彈中,大量用鈦代替鋼鐵。
(1)Al的離子結構示意圖為 ;
Al與NaOH溶液反應的離子方程式為
(2)氮化硅抗腐蝕能力很強,但易被氫氟酸腐蝕,氮化硅與氫氟酸反應生成四氟化硅和一種銨鹽,
其反應方程式為
(3)工業上用化學氣相沉積法制備氮化硅,其反應如下:
3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0
在恒溫、恒容時,分別將0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密閉容器內,進行上述反應,5 min達到平衡狀態,所得HCl(g)為0.3mol/L、 N2為0.05 mol/L
① H2的平均反應速率是
② 反應前與達到平衡時容器內的壓強之比=
③ 系數 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+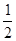 O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
寫出TiO2和焦炭、氯氣反應生成TiCl4和CO氣體的熱化學方程式:
。
查看答案和解析>>
科目:高中化學 來源:2014屆四川成都棠湖中學外語實驗學校高二5月月考化學卷(解析版) 題型:填空題
碳化硅(SiC) 、氧化鋁(Al2O3) 和氮化硅(Si3N4)是優良的高溫結構陶瓷,在工業生產和科技領域有重要用途。宇宙火箭和導彈中,大量用鈦代替鋼鐵。
(1)Al的離子結構示意圖為 ;
Al與NaOH溶液反應的離子方程式為
(2)氮化硅抗腐蝕能力很強,但易被氫氟酸腐蝕,氮化硅與氫氟酸反應生成四氟化硅和一種銨鹽,
其反應方程式為
(3)工業上用化學氣相沉積法制備氮化硅,其反應如下:
3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12
HCl(g) △H<0
Si3N4(s) + 12
HCl(g) △H<0
在恒溫、恒容時,分別將0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密閉容器內,進行上述反應,5 min達到平衡狀態,所得HCl(g)為0.3mol/L、 N2為0.05 mol/L
① H2的平均反應速率是
② 反應前與達到平衡時容器內的壓強之比=
③ 系數 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+ O2(g)===
CO(g) ΔH2 =-110
kJ·mol-1
O2(g)===
CO(g) ΔH2 =-110
kJ·mol-1
寫出TiO2和焦炭、氯氣反應生成TiCl4和CO氣體的熱化學方程式:
。
查看答案和解析>>
科目:高中化學 來源: 題型:
1991年美國的B,M,Trost首次提出了化學反應的原子經濟性的概念。原子經濟性可以用原子利用率來衡量。
原子利用率(%)=![]()
KOH是一種重要的化工原料,廣泛應用于KMnO4、K2CO3的生產。
(1)某同學用KOH、CO2為原料,以提高原子利用率為原則,在實驗室制取K2CO3固體。所設計的兩套方案分別為:
①方案一:
先配制KOH溶液,然后通過過量CO2,再經過蒸發結晶、灼燒得到K2CO3固體。在蒸發結晶過程中用玻璃棒攪拌的目的是
。
②方案二:
第一步驟為:配制KOH溶液并將其等分于兩燒杯中。
第二步驟作為:向其中一燒杯中通入 ,反應的化學方程式為 。
將兩溶液混合,再經蒸發結晶、灼燒便可得到K2CO3固體。
③試從原子經濟性的角度評價上述實驗方案。
。
(2)工業上利用KOH和MnO2為原料制取KMnO4。主要生產過程分兩步進行:
第一步將MnO2和固體KOH粉碎,混合均勻,在空氣中加熱之熔化,并連續攪拌以制取K2MnO4;第二步為電解K2MnO4的濃溶液制取KMnO4。
①第一步反應的化學方程式為 。
②電解K2MnO4的濃溶液時,電解池中陰極的實驗現象為 。
③用KOH、MnO2等為原料制取K2MnO4過程中的原子利用率為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com