
【題目】下列示意圖與化學用語表述內容不相符的是(水合離子用相應離子符號表示)
A | B | C | D |
NaCl溶于水 |
電解CuCl2溶液 |
CH3COOH在水中電離 |
H2與Cl2反應能量變化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
【答案】B
【解析】
本題A、B、C選項應區分電離和電解的概念。電離是電解質溶于水或熔融狀態下,解離成能夠自由移動的離子的過程。根據其電離程度可分為強電解質和弱電解質,幾乎全部電離的是強電解質(如A選項),只有少部分電離的是弱電解質(如C選項);是將電能轉化為化學能的一個裝置(構成:外加電源,電解質溶液,陰陽電極)。使電流通過電解質溶液或熔融電解質而在陰,陽兩極引起還原氧化反應的過程(如B選項)。
A.NaCl為強電解質,NaCl溶于水,NaCl在水分子作用下,自發解離為Na+和Cl-,故電離方程式為NaCl=Na++Cl-,故A不符合題意;
B.電解氯化銅溶液,銅離子向陰極移動,得電子,發生電極反應為:Cu2++2e-=Cu,氯離子向陽極移動,失電子,發生電極反應為:2Cl-+2e-=Cl2,所以電解總反應為:Cu2++2Cl-![]() Cu+Cl2,故B符合題意;
Cu+Cl2,故B符合題意;
C.CH3COOH為弱電解質,溶于水部分電離,因此電離方程式為CH3COOH![]() CH3COO-+H+,故C不符合題意;
CH3COO-+H+,故C不符合題意;
D.由圖可知,反應H2(g)+Cl2(g)=2HCl(g)的反應熱等于斷裂反應物分子中的化學鍵吸收的總能量(436kJ/mol+243kJ/mol=679kJ/mol),與形成生成物分子中化學鍵放出的總能量(431kJ/mol×2=862kJ/mol)之差,即放熱183kJ/mol,放熱H為負值,所以H2(g)+Cl2(g)=2HCl(g)H=-183kJ/mol,故D不符合題意;
綜上所述,本題應選B。


 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源: 題型:
【題目】某芳香族酯類化合物甲的分子式為C14H10O5,1 mol甲水解后只生成一種產物乙,其物質的量為2 mol,下列說法正確的是( )
A. 符合上述條件的甲共有3種B. 1 mol甲最多可以和3 mol NaOH反應
C. 乙不能和溴水發生反應D. 2 mol乙最多可以和1 mol Na2CO3反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在恒容容器中投入一定量純凈的氨基甲酸銨,發生下列反應NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。能判斷該分解反應已經達到化學平衡的是
2NH3(g)+CO2(g)。能判斷該分解反應已經達到化學平衡的是
A.2v(NH3)=v(CO2)
B.密閉容器中混合氣體的密度不變
C.密閉容器中混合氣體的平均摩爾質量不變
D.密閉容器中氨氣的體積分數不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科研人員最近發明了一種水電池,這種電池能利用淡水和海水之間的含鹽量差進行供電,該電池的化學反應為:5MnO2+2Ag+2NaCl→Na2Mn5O10+2AgCl
(1)簡述Na2O熔點比NaCl高的其原因。_______________________
(2)將Al粉和MnO2混合,經高溫引發反生反應,寫出化學反應方程式。__________________________,若反應中生成5.5kg單質,則轉移電子的數目是________個。
(3)元素周期表中,鐵(Fe)和錳(Mn)位于同周期。向化合物X的溶液中,滴加NaOH溶液時,發生反應:X+3NaOH→3Y+Fe(OH)3↓。X的化學式可能是________________、________________。
(4)將SO2通入Fe2(SO4)3溶液中,溶液變為淺綠色,且酸性增強,請寫出離子方程式。______________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】增塑劑DCHP(F)是一種用于生產醫療器械和食品包裝袋的原料,可以由芳香烴為原料制備而得:
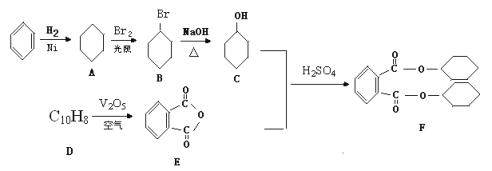
(1)D的結構簡式是_________,D→E的反應類型為_______________。
(2)鑒別苯酚![]() 和化合物C
和化合物C![]() 的試劑為___________。
的試劑為___________。
(3)C的同系物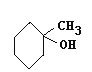 (G)根據系統命名法名稱為____________,若化合物M是G的同分異構體,且分子中核磁共振氫譜顯示有2個吸收峰(一氯代物只有兩種),寫出該化合物的結構簡式是_________。(任寫一種)
(G)根據系統命名法名稱為____________,若化合物M是G的同分異構體,且分子中核磁共振氫譜顯示有2個吸收峰(一氯代物只有兩種),寫出該化合物的結構簡式是_________。(任寫一種)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示為MnO2和濃鹽酸共熱制取氯氣的實驗裝置,反應為:MnO2+4HCl![]() MnCl2+Cl2+2H2O,請回答下列問題:
MnCl2+Cl2+2H2O,請回答下列問題:

(1)打開活塞K,將分液漏斗中的液體加入燒瓶中,觀察D中導管口是否有氣泡產生,__(填:能或不能)驗證裝置的氣密性良好;
(2)C中收集到的Cl2中含有HCl,請從分子結構的角度解釋其中的原因___;
(3)裝置D的作用是___;
(4)B的作用為___(選填下列編號)。
A.洗氣瓶 B.儲氣瓶 C.安全瓶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用20 mL 18.4 mol/L濃H2SO4和銅共熱一段時間后,使反應混合物冷卻,濾去多余的銅,將濾液加水定容到100 mL,測得SO42-離子物質的量濃度為3. 18 mol/L。試求溶液中CuSO4的物質的量濃度( )
A. 0.50 mol/L B. 0.75 mol/L C. 1.00 mol/L D. 3.18 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煙道氣中的NOx是主要的大氣污染物之一,為了監測其含量,選用如下采樣和檢測方法。回答下列問題:
I.采樣
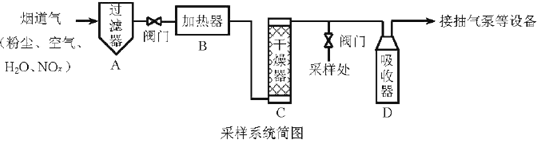
采樣步驟:
①檢驗系統氣密性;②加熱器將煙道氣加熱至140。C;③打開抽氣泵置換系統內空氣;④采集無塵、干燥的氣樣;⑤關閉系統,停止采樣。
II. NOx含量的測定
將VL氣樣通入適量酸化的H2O2溶液中,使NOx完全被氧化為NO3-,加水稀釋至100.00 mL。量取20.00 mL該溶液,加入V1 mL c1 mol·L-1 FeSO4標準溶液(過量),充分反應后,用c2 mol·L-1 K2Cr2O7標準溶液滴定剩余的Fe2+,終點時消耗V2 mL。
(1)NO被H2O2氧化為NO3-的離子方程式是___________。
(2)滴定操作使用的玻璃儀器主要有___________。
(3)滴定過程中發生下列反應:
3Fe2+ +NO3-+4H+ = NO↑+3Fe3+ +2H2O
Cr2O72-+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
則氣樣中NOx折合成NO2的含量為_________mg·m-3。
(4)判斷下列情況對NOx含量測定結果的影響(填“偏高” 、“偏低”或“無影響 ”)若缺少采樣步驟③,會使測試結果___________。若FeSO4標準溶液部分變質,會使測定結果___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用鋁灰(主要成分為Al、Al2O3、AlN、FeO等)制備鋁鞣劑[主要成分為Al(OH)2Cl]的一種工藝如圖:
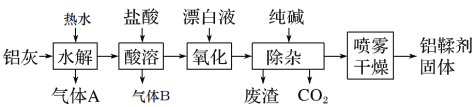
(1)氣體A能使濕潤的紅色石蕊試紙變藍。鋁灰在90℃時水解生成A的化學方程式為:__,“水解”采用90℃而不在室溫下進行的原因是___。
(2)“酸溶”時,生成氣體B的離子方程式為___。
(3)“氧化”時反應的離子方程式為___。
(4)“除雜”中反應的離子方程式為__。
(5)“噴霧干燥”是將需干燥的物料,分散成很細的像霧一樣的微粒,與熱空氣接觸,在瞬間將大部分水分除去,使物料中的固體物質干燥成粉末。采用噴霧干燥而不用蒸發可有效防止產品的水解或分解,寫出Al(OH)2Cl在較高溫度下分解的化學方程式___。“噴霧干燥”中將需干燥的物料,分散成很細的微粒的目的是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com