
【題目】由三種元素組成的化合物A,按如下流程進行實驗。氣體B為純凈物,溶液C焰色反應為磚紅色,氣體E能使濕潤的紅色石蕊試紙變藍。
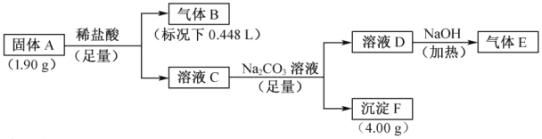
請回答:
(1)組成A的三種元素是________,A的化學式是________。
(2)固體A與足量稀鹽酸反應的化學方程式是________。
(3)氣體E與甲醛在一定條件可生成烏洛托品(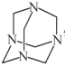 學名:六亞甲基四胺),該反應的化學方程式是________(烏洛托品可以用分子式表示)。
學名:六亞甲基四胺),該反應的化學方程式是________(烏洛托品可以用分子式表示)。
【答案】![]() 、
、![]() 、
、![]()
![]()
![]()
![]()
 (或
(或![]() )
)![]()
【解析】
溶液C焰色反應為磚紅色說明溶液C中含有Ca元素,可知沉淀F為CaCO3,4.00g碳酸鈣的物質的量為![]() ,根據元素守恒可知固體A中含有Ca元素,其質量為0.04mol×40g/mol=1.60g;氣體E能使濕潤的紅色石蕊試紙變藍說明氣體E為NH3,所以溶液D中含有NH4+,根據元素守恒可知溶液C中含有N元素,固體A中含有N元素;氣體B為純凈物,其物質的量為
,根據元素守恒可知固體A中含有Ca元素,其質量為0.04mol×40g/mol=1.60g;氣體E能使濕潤的紅色石蕊試紙變藍說明氣體E為NH3,所以溶液D中含有NH4+,根據元素守恒可知溶液C中含有N元素,固體A中含有N元素;氣體B為純凈物,其物質的量為![]() ,固體A中Ca元素的質量為1.60g,則其他元素為1.90g-1.60g=0.30g,可先假設E為一種常見的氣體,若該氣體為NO、NO2、O2,則固體A中另外一種元素為O,而0.02mol NO或NO2或O2所含氧元素的質量均大于0.30g,故不合理,若該氣體為H2,固體A中另外一種元素為H,則符合題意,同時可以參考CaH2與水的歸中反應生成氫氣。
,固體A中Ca元素的質量為1.60g,則其他元素為1.90g-1.60g=0.30g,可先假設E為一種常見的氣體,若該氣體為NO、NO2、O2,則固體A中另外一種元素為O,而0.02mol NO或NO2或O2所含氧元素的質量均大于0.30g,故不合理,若該氣體為H2,固體A中另外一種元素為H,則符合題意,同時可以參考CaH2與水的歸中反應生成氫氣。
(1)根據分析可知固體A中的三種元素為:Ca、N、H;Ca的常見化合價為+2價,已知固體A中Ca元素的物質的量為0.04mol,質量為1.60g,N元素的和H元素質量為0.04g共0.30g,N的相對原子質量為14,氫的相對原子質量為1,據此可推測A的化學式可能為Ca4N2H2,化為最簡整數比為![]() ;
;
(2)根據產物可知A與鹽酸反應的產物中含有NH4+,H2,Ca2+,根據電子守恒和元素守恒可知方程式為:![]() ;
;
(3)氣體E為為NH3,甲醛為HCHO,根據元素守恒可知方程式為:![]()
 (或
(或![]() )
)![]() 。
。


 一線名師提優試卷系列答案
一線名師提優試卷系列答案科目:高中化學 來源: 題型:
【題目】金屬鎵(Ga)應用廣泛,在半導體和光電材料、合金、磁性材料等領域都有重要應用。鎵與鋁是同主族元素,性質相似。
(1)鋁在元素周期表中的位置是__________________。
(2)GaAs 是一種重要的半導體材料。As 與 Ga 同周期,As 與 N 同主族。
①下列事實不能用元素周期律解釋的是___________(填字母)。
a. 堿性:Ga (OH)3> Al (OH)3 b. 非金屬性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合價為-3 價,用原子結構理論解釋原因_________________。
③廢棄含 GaAs 半導體材料可以用濃硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,寫出該反應的化學方程式_________。
(3)工業上獲取鎵的方法之一是從閃鋅礦冶鋅后的殘渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研單位設計下述流程提取鎵,已知:Ga 在堿性溶液中以[Ga(OH)4]- 形式存在。
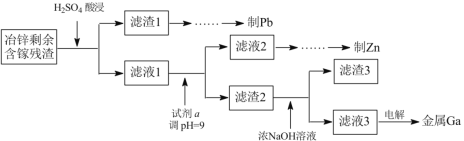
①試劑 a 是_______________。
②寫出電解制鎵時的陰極電極反應式__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是氧化鎂和氯化鎂的熔、沸點數據:
物質 | 氧化鎂 | 氯化鎂 |
熔點/℃ | 2852 | 714 |
沸點/℃ | 3600 | 1412 |
請參考以上數據分析,從海水中提取鎂,正確的方法是( )
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液→MgCl2晶體
MgCl2溶液→MgCl2晶體![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2(熔融)
MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NA是阿伏加德羅常數的值,下列說法正確的是( )
A.1L0.1molL-1H2C2O4溶液中含C2O![]() 離子數為0.1NA
離子數為0.1NA
B.2molNO與2molO2在密閉容器中充分反應,轉移的電子數為8NA
C.32gS8與S6(![]() )的混合物中所含共價鍵數目為NA
)的混合物中所含共價鍵數目為NA
D.標準狀況下22.4L氯氣與甲烷的混合氣體,光照時充分反應生成HCl分子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)比較給出![]() 能力的相對強弱:
能力的相對強弱:![]() ________
________![]() (填“>”“<”或“=”);用一個化學方程式說明
(填“>”“<”或“=”);用一個化學方程式說明![]() 和
和![]() 結合
結合![]() 能力的相對強弱________。
能力的相對強弱________。
(2)![]() 是離子化合物,各原子均滿足8電子穩定結構。寫出
是離子化合物,各原子均滿足8電子穩定結構。寫出![]() 的電子式________。
的電子式________。
(3)在常壓下,甲醇的沸點(65℃)比甲醛的沸點(-19℃)高。主要原因是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵被譽為“第一金屬”,鐵及其化合物在生活中有廣泛應用。回答下列問題:
(1)基態Fe3+的電子排布式為________。
(2)實驗室用KSCN溶液、苯酚(![]() )檢驗Fe3+。N、O、S的第一電離能由大到小的順序為_______(用元素符號表示),苯酚中碳原子的雜化軌道類型為______。
)檢驗Fe3+。N、O、S的第一電離能由大到小的順序為_______(用元素符號表示),苯酚中碳原子的雜化軌道類型為______。
(3)FeCl3的熔點為306℃,沸點為315℃ FeCl3的晶體類型是______。FeSO4常作補鐵劑,SO42-的立體構型是_______。
(4)羰基鐵[Fe(CO)5]可用作催化劑、汽油抗爆劑等,1 mol Fe(CO)5分子中含σ鍵數目為_______,與CO互為等電子體的離子是__________(填化學式,寫一種)
(5)氮化鐵晶體的晶體結構示意圖如圖所示。該晶體中鐵、氮的微粒個數之比為______。
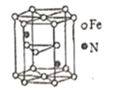
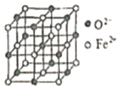
(6)氧化亞鐵晶體的晶胞如圖所示。已知:氧化亞鐵晶體的密度為ρg·cm-1,NA代表阿伏加德羅常數的值。在該晶胞中,與Fe2+緊鄰且等距離的Fe2+數目為_____;Fe2+與O2-的最短間距為_______ pm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組以芳香族化合物A為起始原料,按下列路線合成高血壓藥物阿替洛爾。
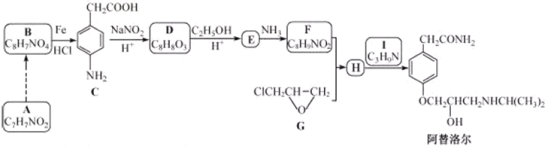
已知:化合物H中除了苯環還有其它環
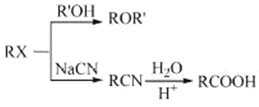 :
:![]()
請回答:
(1)下列說法正確的是________。
A.化合物D能發生加成,取代,氧化反應,不發生還原反應
B.化合物E能與![]() 溶液發生顯色反應
溶液發生顯色反應
C.化合物1具有弱堿性
D.阿替洛爾的分子式是![]()
(2)寫出化合物E的結構簡式________。
(3)寫出![]() 的化學方程式________。
的化學方程式________。
(4)設計從A到B的合成路線(用流程圖表示,無機試劑任選)________。
(5)寫出化合物C同時符合下列條件的同分異構體的結構簡式________。
①![]() 譜和IR譜檢測表明:分子中共有4種氫原子,無氮氧鍵和碳氮雙鍵;
譜和IR譜檢測表明:分子中共有4種氫原子,無氮氧鍵和碳氮雙鍵;
②除了苯環外無其他環。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧元素為地殼中含量最高的元素,可形成多種重要的單質和化合物。
(1)氧元素位于元素周期表中___________區;第二周期元素中,第一電離能比氧大的有___________種。
(2)O3可用于消毒。O3的中心原子的雜化形式為___________;其分子的 VSEPR模型為___________,與其互為等電子體的離子為___________(寫出一種即可)。
(3)含氧有機物中,氧原子的成鍵方式不同會導致有機物性質不同。解釋C2H5OH的沸點高于CH3OCH3的原因為___________;C2H5OH不能用無水CaCl2千燥是因為Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,該離子的結構式可表示為______________________。
(4)氧元素可分別與Fe和Cu形成低價態氧化物FeO和Cu2O。

①FeO立方晶胞結構如圖1所示,則Fe2+的配位數為___________;與O2-緊鄰的所有Fe2+構成的幾何構型為___________。
②Cu2O立方晶胞結構如圖2所示,若O2-與Cu+之間最近距離為a pm,則該晶體的密度為___________g·cm-3。(用含a、NA的代數式表示,NA代表阿伏加德羅常數的值)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:常溫下,0.01 mol/L MOH溶液的pH為10,MOH(aq)與H2SO4(aq)反應生成1 mol正鹽的ΔH=-24.2 kJ·mol-1,強酸與強堿的稀溶液的中和熱為ΔH=-57.3 kJ·mol-1。則MOH在水溶液中電離的ΔH為( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com