
| A. | 常溫下,加水稀釋0.01mol•L-1的氨水,c(NH4+)•c(OH-)逐漸增大 | |
| B. | 在H2SO3溶液中滴加少量NaClO溶液,c(SO32-)逐漸增大 | |
| C. | 在H2S溶液中滴加CuSO4溶液,H2S的電離程度逐漸增大 | |
| D. | 微熱醋酸溶液,$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$保持不變 |
分析 A.常溫下,加水稀釋促進一水合氨電離,但一水合氨電離增大程度小于溶液體積增大程度,所以溶液中c(NH4+)、c(OH-)都減小;
B.在H2SO3溶液中滴加少量NaClO溶液,二者發生氧化還原反應生成Cl-、SO42-;
C.硫化氫存在電離平衡H2S?HS-+H+、HS-?H++S2-,在H2S溶液中滴加CuSO4溶液,發生反應H2S+Cu2+=CuS↓+2H+;
D.弱電解質的電離是吸熱反應,升高溫度促進醋酸電離.
解答 解:A.常溫下,加水稀釋促進一水合氨電離,但一水合氨電離增大程度小于溶液體積增大程度,所以溶液中c(NH4+)、c(OH-)都減小,導致c(NH4+)•c(OH-)逐漸減小,故A錯誤;
B.在H2SO3溶液中滴加少量NaClO溶液,二者發生氧化還原反應生成Cl-、SO42-,導致溶液中c(SO32-)逐漸減小,故B錯誤;
C.硫化氫存在電離平衡H2S?HS-+H+、HS-?H++S2-,在H2S溶液中滴加CuSO4溶液,發生反應H2S+Cu2+=CuS↓+2H+,H2S的電離程度逐漸增大,故C正確;
D.弱電解質的電離是吸熱反應,升高溫度促進醋酸電離,所以醋酸電離平衡常數K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故D錯誤;
故選C.
點評 本題考查弱電解質的電離,為高頻考點,涉及弱電解質的電離、氧化還原反應、復分解反應等知識點,明確弱電解質電離特點是解本題關鍵及發生的反應是解本題關鍵,注意:電離平衡常數只與溫度有關,與溶液濃度無關,易錯選項是BC.


科目:高中化學 來源: 題型:選擇題
| A. | 2種 | B. | 5種 | C. | 6種 | D. | 8種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 難溶物 | CaF2 | CaC2O4 |
| Ksp | 3.5×10-11 | 2.3×10-9 |
| 酸 | HF | H2C2O4 |
| 電離常數 | Ka=7.2×10-4 | Ka1=5.4×10-2 Ka2=5.4×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
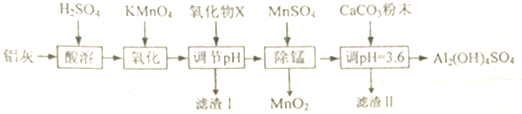
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 開始沉淀時 | 3.4 | 6.3 | 1.5 |
| 完全沉淀時 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
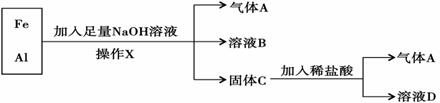
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4 mol | B. | 2.5 mol | C. | 2 mol | D. | 0.5 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為32 | B. | 質量數為15 | ||
| C. | ${\;}_{15}^{32}$P與${\;}_{15}^{33}$P互為同位素 | D. | 中子數為15 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com