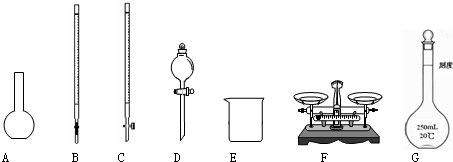
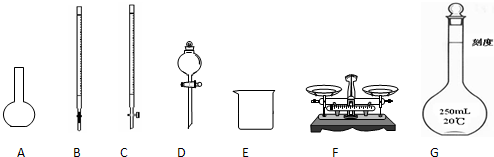
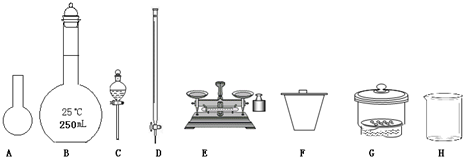
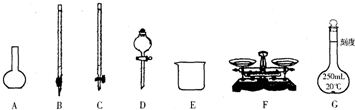
某化學興趣小組測定某FeCl
3樣品(含有少量FeCl
2雜質)中鐵元素的質量分數,實驗時按以下步驟進行:
①稱量ag樣品,置于燒杯中,
②加入適量的蒸餾水,使樣品溶解,然后準確配制成250mL溶液
③準確量取25.00mL步驟②中配得的溶液,置于燒杯中,加入適量的氯水,加熱使反應完全
④趁熱迅速加入過量氨水,充分攪拌,使沉淀完全
⑤過濾,洗滌沉淀
⑥將沉淀聲稱到坩堝內加熱,攪拌直到固體全部由紅褐色變為紅棕色后在干燥器中冷卻到室溫后,稱量
⑦…根據上面敘述,回答
(1)如圖所示儀器中,本實驗步驟①②中必須用到的儀器是
BE
BE
.
(2)寫出步驟③和④中發生反應的離子方程式
2Fe2++Cl2=2Fe3++2Cl-;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
2Fe2++Cl2=2Fe3++2Cl-;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
(3)洗滌是洗去附著在沉淀上的
NH4+、Cl-、OH-
NH4+、Cl-、OH-
(寫離子符號).洗滌沉淀的操作是
向過濾器中加入蒸餾水至沒過沉淀,待濾液流出后重復上述操作多次直至洗凈為止
向過濾器中加入蒸餾水至沒過沉淀,待濾液流出后重復上述操作多次直至洗凈為止
檢驗沉淀已洗凈的方法是
取最次一次洗出液置于小試管中,滴加AgNO3溶液若無沉淀產生證明已洗凈
取最次一次洗出液置于小試管中,滴加AgNO3溶液若無沉淀產生證明已洗凈
(4)若坩堝質量是W
1,坩堝與加熱后固體總質量是W
2,則樣品中鐵元素的質量分數為
(列出算式,不需化簡)
(5)該興趣小組中甲學生認為:實驗步驟中不加氨水,其余步驟不變,仍可達到實驗目的,你認為甲學的觀點是否正確
正確
正確
(填“正確”或“錯誤”)請說明理由(必要時可用化學方程式表示)
氯化鐵溶液中Fe3+水解Fe3++3H2O?Fe(OH)3+3H+,加熱HCl揮發,促進水解進行,過一系列轉化最終都能生成Fe2O3對后續實驗無影響
氯化鐵溶液中Fe3+水解Fe3++3H2O?Fe(OH)3+3H+,加熱HCl揮發,促進水解進行,過一系列轉化最終都能生成Fe2O3對后續實驗無影響
.



 全優沖刺100分系列答案
全優沖刺100分系列答案 英才點津系列答案
英才點津系列答案 紅果子三級測試卷系列答案
紅果子三級測試卷系列答案