
【題目】運用化學反應原理研究碳、氮、硫的單質及其化合物的反應對緩解環境污染、能源危機具有重要意義。
I.氨為重要的化工原料,有廣泛用途。
(1)合成氨中的氫氣可由下列反應制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
則反應CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始時投入氮氣和氫氣的物質的量分別為1mol、3mol,在不同溫度和壓強下合成氨。平衡時混合物中氨的體積分數與溫度的關系如圖。

①恒壓時,反應一定達到平衡狀態的標志是_____________(填序號)
A.![]() 和
和![]() 的轉化率相等 B.反應體系密度保持不變
的轉化率相等 B.反應體系密度保持不變
C.![]() 保持不變 D.
保持不變 D.![]()
②P1_____P2 (填“>”“=”或“不確定”,下同);反應的平衡常數:B點_______D點。
③C點![]() 的轉化率為________;在A、B兩點條件下,該反應從開始到平衡時生成氮氣的平均速率:υ(A)__________υ(B)。
的轉化率為________;在A、B兩點條件下,該反應從開始到平衡時生成氮氣的平均速率:υ(A)__________υ(B)。
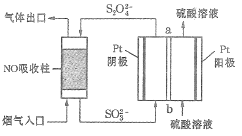
Ⅱ.用間接電化學法去除煙氣中NO的原理如下圖所示。
已知陰極室溶液呈酸性,則陰極的電極反應式為_____________。反應過程中通過質子交換膜(ab)的![]() 為2mol時,吸收柱中生成的氣體在標準狀況下的體積為_____________L。
為2mol時,吸收柱中生成的氣體在標準狀況下的體積為_____________L。
【答案】+175.2kJ/mol BC < > 66.7% < 2SO32-+4H++2e-=S2O42-+2H2O 11.2
【解析】
I.(1)則將a+b可得CH4(g)+2H2O(g)CO2(g)+4H2(g) △H;
(2)①起始時投入氮氣和氫氣分別為1mol、3mol,在不同溫度和壓強下合成氨,達到平衡時,正、逆反應速率相等,各物質的濃度不變,氣體的總物質的量不變,以此判斷;
②增大壓強,平衡正向移動,平衡混合氣體中氨氣的百分含量增大;升高溫度,平衡逆向移動,平衡常數減小;
③起始時投入氮氣和氫氣分別為1mol、3mol,反應的方程式為N2(g)+3H2(g)2NH3(g),C點氨氣的含量為50%,結合方程式計算;壓強越大、溫度越高,反應速率越快;
II.根據圖示可知,陰極通入的SO32-發生得電子的還原反應生成S2O42-,結合溶液為酸性書寫陰極反應式;寫出電解池的總反應,根據通過的氫離子物質的量可知轉移電子的物質的量,吸收柱中生成的氣體為氮氣,然后利用電子守恒計算氮氣的物質的量,最后根據V=nVm計算標況下體積。
I.(1)已知a.CH4(g)+H2O(g)CO(g)+3H2(g)△H=+216.4kJ/mol
b.CO(g)+H2O(g)CO2(g)+H2(g)△H=-41.2kJ/mol
則將a+b,可得CH4(g)+2H2O(g)CO2(g)+4H2(g) △H=(+216.4-41.2)kJ/mol=+175.2kJ/mol;
(2)①A.N2和H2的起始物料比為1:3,且按照1:3反應,則無論是否達到平衡狀態,轉化率都相等,N2和H2轉化率相等不能用于判斷是否達到平衡狀態,A錯誤;
B.氣體的總質量不變,由于該反應的正反應是氣體體積減小的反應,恒壓條件下,當反應體系密度保持不變時,說明體積不變,則達到平衡狀態,B正確;
C.![]() 保持不變,說明氫氣、氨氣的濃度不變,反應達到平衡狀態,C正確;
保持不變,說明氫氣、氨氣的濃度不變,反應達到平衡狀態,C正確;
D.達平衡時各物質的濃度保持不變,但不一定等于化學計量數之比,![]() 不能確定反應是否達到平衡狀態,D錯誤;
不能確定反應是否達到平衡狀態,D錯誤;
故合理選項是BC;
②由于該反應的正反應是氣體體積減小的反應,增大壓強,平衡正向移動,平衡混合氣體中氨氣的百分含量增大,由圖象可知P1<P2,該反應的正反應是放熱反應,升高溫度,平衡逆向移動,平衡常數減小,則反應平衡常數:B點>D點;
③起始時投入氮氣和氫氣分別為1mol、3mol,反應的方程式為N2(g)+3H2(g)2NH3(g),C點氨氣的含量為50%,設轉化N2物質的量為xmol,則
N2(g) +3H2(g) 2NH3(g)
起始:1mol 3mol 0
轉化:x mol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
則![]() ×100%=50%,解得x=
×100%=50%,解得x=![]() ,則C點H2的轉化率為
,則C點H2的轉化率為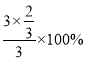 =66.7%,B點的壓強、溫度都比A點高,壓強越大、溫度越高,反應速率越大,所以υ(A)<υ(B);
=66.7%,B點的壓強、溫度都比A點高,壓強越大、溫度越高,反應速率越大,所以υ(A)<υ(B);
II.根據圖示可知,陰極通入的SO32-發生得電子的還原反應生成S2O42-,則陰極反應式為:2SO32-+4H++2e-=S2O42-+2H2O;電解池的陽極水電離出的氫氧根離子放電生成氧氣,發生反應為:2H2O-4e-=4H++O2↑,則電解池中總反應為:4SO32-+4H+![]() 2S2O42-+2H2O+O2↑,即轉移4mol電子時有4mol氫離子通過質子交換膜,則反應過程中通過質子交換膜(ab)的H+為2mol時,轉移電子的物質的量為2mol,生成1molS2O42-,圖示NO吸收柱中S2O42-失去電子被氧化成SO32-,NO得到電子被還原成N2,根據得失電子守恒可知,吸收柱中生成N2的物質的量為:n(N2)=
2S2O42-+2H2O+O2↑,即轉移4mol電子時有4mol氫離子通過質子交換膜,則反應過程中通過質子交換膜(ab)的H+為2mol時,轉移電子的物質的量為2mol,生成1molS2O42-,圖示NO吸收柱中S2O42-失去電子被氧化成SO32-,NO得到電子被還原成N2,根據得失電子守恒可知,吸收柱中生成N2的物質的量為:n(N2)=![]() =0.5mol,標況下0.5mol氮氣的體積為:22.4L/mol×0.5mol=11.2L。
=0.5mol,標況下0.5mol氮氣的體積為:22.4L/mol×0.5mol=11.2L。


科目:高中化學 來源: 題型:
【題目】A、B、C、D四物質有如下轉化關系(反應條件和部分產物已略去):A![]() B
B![]() C
C![]() D。回答下列問題:
D。回答下列問題:
(1)若A為氣態氫化物和D能通過化合反應生成一種鹽,則:
①簡述檢驗A氣體的方法_________________________________________;
②寫出D制備B的離子方程式_________________________________________;
③寫出由A生成B的化學方程式_________________________________________;
④某同學用干燥的圓底燒瓶收集一瓶A氣體,用滴入酚酞的水做噴泉實驗,能觀察到美麗的紅色噴泉。用方程式解釋噴泉呈紅色的原因______________________________;
(2)若A與B反應能生成一種淡黃色固體單質。寫出B→C的化學方程式_____________;
(3)若A是金屬單質,C是一種淡黃色固體。寫出C的電子式________說出C的一種用途_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】納米Fe3O4晶體材料可以作為核磁共振造影增強劑,用于疾病的診斷和治療,其制備過程如圖所示,下列敘述不合理的是
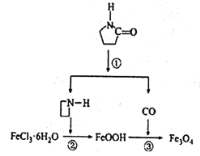
A. 在反應②中,![]() 的作用可能是促進氯化鐵水解
的作用可能是促進氯化鐵水解
B. 直接加熱FeCl3溶液也可以得到Fe3O4
C. 反應③的化學方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D. 納米四氧化三鐵形成的分散系,有可能產生丁達爾效應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ba(NO3)2可用于生產煙花。某主要生產BaCl2、BaCO3、BaSO4的化工廠利用某種鋇泥[主要含有BaCO3、Ba(FeO2)2、極少量CuCO3等]制取Ba(NO3)2晶體,其部分工藝流程如下:
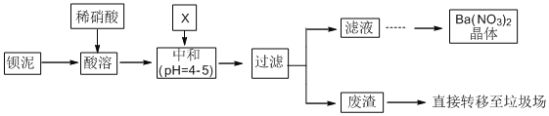
已知:Fe3+和Fe2+以氫氧化物形式沉淀完全時,溶液的pH分別為3.2和9.7。
(1)酸溶時不使用濃硝酸的原因是_________________________________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2與HNO3的反應化學方程式為__________________。
(3)該廠結合本廠實際,中和選用的X為____________(填化學式);中和使溶液中______(填離子符號)的濃度減少(中和引起的溶液體積變化可忽略)。
(4)濾液得到Ba(NO3)2晶體的操作依次為_________、_________、過濾。
(5)該廠生產的Ba(NO3)2晶體含有少量Cu2+。化學上通過惰性電極電解法富集Cu時,發現電解裝置的陰極還有少量使紅色石蕊試紙變藍的氣體生成。生成該氣體的電極反應為______________________________。
(6)Ba2+致死量為355mg/kg。誤食Ba2+可以服用MgSO4溶液解毒,涉及到的離子反應方程式為___________;為了減少環境污染,請對上述流程中不合理的設計進行改進,改進措施是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃、101 kPa下,2g氫氣燃燒生成液態水,放出285.8kJ熱量,表示該反應的熱化學方程式正確的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香族化合物A(![]() )是重要的有機化工原料。由A制備有機化合物F的合成路線(部分反應條件略去)如下圖所示:
)是重要的有機化工原料。由A制備有機化合物F的合成路線(部分反應條件略去)如下圖所示:
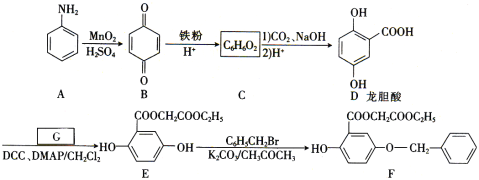
(1)A的分子式是______,B含有的官能團的名稱是_________。
(2)D→E的反應類型是_________。
(3)已知G能與金屬鈉反應,則G的結構簡式為________。
(4)寫出E→F的化學方程式:_________。
(5)龍膽酸D的同分異構體有多種,符合下列條件的有___種。寫出其中一種核磁共振氫譜有六組峰的同分異構體的結構簡式:____。
①能發生銀鏡反應;②與FeCl3溶液發生顯色反應;③1mol該物質能與2mol Na2CO3反應。
(6)已知: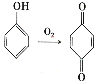 。參照上述合成路線,設計一條以苯酚、乙醇為原料制備龍膽酸乙酯(
。參照上述合成路線,設計一條以苯酚、乙醇為原料制備龍膽酸乙酯(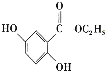 )的合成路線(無機試劑任用)。_________
)的合成路線(無機試劑任用)。_________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家研制出一種催化劑,能在室溫下高效催化空氣中HCHO的氧化,其反應如下:HCHO+O2![]() CO2+H2O。下列有關說法正確的是( )
CO2+H2O。下列有關說法正確的是( )
A. HCHO含有的官能團為羧基
B. CO2分子是由極性鍵形成的極性分子
C. HCHO分子中既含σ鍵又含π鍵
D. 每生成18 g H2O消耗22.4 L O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵鉻氧化還原液流電池是一種低成本的儲能電池,電池結構如圖所示,工作原理為Fe3++Cr2+![]() Fe2++Cr3+。下列說法正確的是( )
Fe2++Cr3+。下列說法正確的是( )
![]()
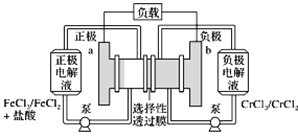
A. 電池放電時,a極的電極反應式為Fe3++3e===Fe
B. 電池放電時,電路中每通過0.1 mol電子,Fe3+濃度降低0.1 mol·L1
C. 電池充電時,Cl從a極穿過選擇性透過膜移向b極
D. 電池充電時,b極的電極反應式為Cr3++e===Cr2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,除標出的元素外,表中的每個編號表示一種元素,請根據要求回答下列問題。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | |||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)①和②兩種元素的非金屬性強弱關系是:①________②(填“>”或“<”)。
(2)③和⑥兩種元素形成的化合物中含有的化學鍵為__________(填“離子鍵”或“共價鍵”) 。
(3)元素②和⑤組成的化合物屬于_________(填“酸性”“堿性”或“兩性”)氧化物。
(4)工業上冶煉元素④所形成的單質,其相關反應的化學方程式為_________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com