
【題目】人們應用原電池原理制作了多種電池以滿足不同的需要。在現代生活、生產和科學
技術發展中,電池發揮著越來越重要的作用,如在宇宙飛船、人造衛星、空間電視轉播站、飛機、輪船、電腦、收音機、照相機、電子手表、心臟起搏器等,都離不開各式各樣的電池,同時廢棄的電池隨便丟棄也會對環境造成污染。請根據題中提供的信息,回答下列問題:
電子表和電子計算器中所用的是紐扣式微型銀鋅電池,其電極分別為Ag2O和Zn,電解質為KOH溶液,工作時電池總反應為Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作時電流從________極流向________極(填“Ag2O”或“Zn”)。
②電極反應式:正極:_____________________,負極:_____________________。
③工作時電池正極區的pH________(填“增大”、“減小”或“不變”)。氫鎳電池是近年來開發出來的可充電電池,它可以取代會產生鎘污染的鎘鎳電池。氫鎳電池的總反應式是![]() H2+NiO(OH)
H2+NiO(OH) ![]() Ni(OH)2。
Ni(OH)2。
電池放電時, 負極的電極反應式為_________,正極的電極反應式為________________,正極附近溶液的pH__________(填“增大”,“減小”或者“不變”)
【答案】 Ag2O Zn Ag2O+2e-+H2O===2Ag+2OH- Zn-2e-+2OH-===Zn(OH)2 增大 ![]() H2-e-+OH-===H2O NiO(OH)+e-+H2O===Ni(OH)2+OH- 增大
H2-e-+OH-===H2O NiO(OH)+e-+H2O===Ni(OH)2+OH- 增大
【解析】(1)①在反應Ag2O+Zn+H2O═2Ag+Zn(OH)2中,由化合價變化可知Zn被氧化,應為原電池的負極,則正極為Ag2O,電流由正極Ag2O流向負極Zn;
②該電池中Zn失電子為負極,負極電極反應式為Zn+2OH--2e-=Zn(OH)2;正極是Ag2O,正極的電極反應式為Ag2O+H2O+2e-=2Ag+2OH-;
③已知電池工作時正極的電極反應式為Ag2O+H2O+2e-=2Ag+2OH-,反應生成氫氧根離子,所以正極區PH增大;
(2)原電池放電時,失電子發生氧化反應的電極是負極,該電池放電時氫氣失電子發生氧化反應,所以通入氫氣的電極是負極,則負極電極反應式為![]() H2-e-+OH-===H2O,正極電極反應式為NiO(OH)+e-+H2O===Ni(OH)2+OH-;放電時,正極反應式為NiO(OH)+e-+H2O===Ni(OH)2+OH-,氫氧根離子濃度升高,溶液的pH增大。
H2-e-+OH-===H2O,正極電極反應式為NiO(OH)+e-+H2O===Ni(OH)2+OH-;放電時,正極反應式為NiO(OH)+e-+H2O===Ni(OH)2+OH-,氫氧根離子濃度升高,溶液的pH增大。


 新課標快樂提優暑假作業陜西旅游出版社系列答案
新課標快樂提優暑假作業陜西旅游出版社系列答案 暑假銜接培優教材浙江工商大學出版社系列答案
暑假銜接培優教材浙江工商大學出版社系列答案 欣語文化快樂暑假沈陽出版社系列答案
欣語文化快樂暑假沈陽出版社系列答案科目:高中化學 來源: 題型:
【題目】某實驗小組進行物質漂白性的實驗探究
Ⅰ.應用下圖所示的方法實驗,其中氣體A的主要成分是氯氣,雜質是空氣和水蒸氣。回答下列問題:
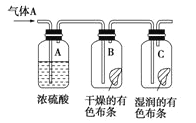
(1)該項研究(實驗)的主要目的是___________________。
(2)濃硫酸的作用是____________,與研究目的直接相關的實驗現象是__________________________。
(3)將石蕊試液滴到新制氯水中的現象_______________________。
Ⅱ.為探究SO2的漂白是SO2直接作用于有色物質,還是SO2與水反應的產物H2SO3的作用,設計如圖裝置進行實驗:(圖中所用硫酸的質量分數為70%)
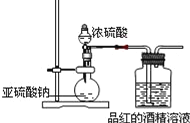

(1)為探究干燥的SO2 能不能使品紅褪色,請指出設計的實驗裝置圖中兩個明顯的不足中的一個______________
(2)按照修改后的裝置,實驗中控制SO2以大約每秒3個氣泡的速度通過品紅的酒精溶液時,經過一小時后,品紅仍不褪色.這說明品紅褪色的原因不是SO2直接導致.所以,SO2 通過品紅水溶液后,引起品紅褪色的可能是________.(填化學式)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.調味劑和著色劑是食品添加劑,添加量越多越好
B.鉀是人體必需的微量元素,食鹽的主要成分是KCl
C.維牛素C在人體內有重要功能,維生素C不溶于水
D.蔬菜、水果富含膳食纖維,適量攝入有利人體健康
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向20mL0.1molL-1鹽酸溶液中逐滴加入等濃度的氨水溶液,溶液中pH與pOH(pOH=一lgc(OH-))的變化關系如圖所示。下列說法正確的是

A.b點消耗氨水的體積為20mL
B.PH>7時,溶液中都一定有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.a點和c點所示溶液中水所電離出的c(OH-)分別為10-9molL-1和10-5molL-1
D.ab段所示溶液中相關離子濃度關系可能為:c(NH4+)>c(Cl-)>C(NH3·H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作中錯誤的是( )
A. 分液時,分液漏斗下層液體從下口放出,上層液體從上口倒出
B. 蒸餾時,應使溫度計水銀球靠近蒸餾燒瓶支管口
C. 蒸發結晶時應將溶液蒸干
D. 稱量時,稱量物放在稱量紙上置于托盤天平的左盤,砝碼放在托盤天平的右盤中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種氣態烷烴和一種氣態烯烴的混合物9 g,其密度是相同條件下氫氣目的的11.25倍。當混合氣體通過足量的溴水時,溴水增重4.2 g,則這兩種氣態烴是( )
A.乙烷和乙烯 B.甲烷和丁烯 C.甲烷和丙烯 D.甲烷和乙烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某溶液中僅存在Na+、Fe3+、SO42-三種離子,已知Na+和SO42-個數比為3:2,則Na+、Fe3+和SO42-三種離子的個數比為( )
A.6:1:9 B.3:1:2 C.1:1:1 D. 9:1:6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器中,進行如下化學反應:CO(g)+H2O(g)![]() CO2(g)+H2(g),其化學平衡常數K和溫度t的關系如下表:
CO2(g)+H2(g),其化學平衡常數K和溫度t的關系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列問題:
(1)該反應的化學平衡常數表達式為K=__________,該反應為______反應(填吸熱或放熱)。[
若改變條件使平衡向正反應方向移動,則平衡常數_________(填序號)
①一定不變②一定減小③可能增大④增大、減小、不變皆有可能
(2)能判斷該反應是否達到化學平衡狀態的依據是___________。
(a)容器中壓強不變(b)混合氣體中c(CO)不變
(c)v逆(H2)=v正(H2O)(d)c(CO)=c(CO2)
(3)將不同量的CO(g)和H2O(g)分別通入到體積為2L的恒容密閉容器中,進行反應
CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三組數據:
CO2(g)+H2(g),得到如下三組數據:
實驗組 | 溫度/℃[ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①實驗B中平衡時H2O(g)的物質的量是。
②通過計算可知,CO的轉化率實驗A實驗B(填“大于”、“等于”或“小于”)。
③若實驗C中達到平衡所需時間t3(填“大于”、“等于”或“小于”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com