
【題目】X、Y、Z、Q、W、R六種短周期元素原子序數依次增大。化合物甲俗稱苛性鈉,由X、Z、Q三種元素組成。醫學中常用QR溶液配制生理鹽水。化合物乙由X、R兩種元素組成。請回答下列問題:
(1)Q的離子結構示意圖為__。
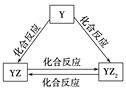
(2)Y元素的單質及其化合物能發生如上圖所示的轉化,則Y元素為___(填元素符號)。在甲溶液中通入足量YZ2氣體,寫出該反應的離子方程式:______。
(3)W的單質既能與甲溶液反應,又能與乙溶液反應。
①常溫下,將W的單質和甲溶液混合,發生反應的離子方程式為_______。
②Q、W兩種元素金屬性的強弱為Q____W(填“<”或“>”),下列表述中能證明這一事實的是____(填序號)。
a.Q單質的熔點比W單質的低
b.W的原子序數大
c.Q的最高價氧化物的水化物的堿性比W的最高價氧化物的水化物的堿性強
【答案】 ![]() C CO2+OH-===HCO
C CO2+OH-===HCO![]() 2Al+2OH-+2H2O===2AlO
2Al+2OH-+2H2O===2AlO![]() +3H2↑ > c
+3H2↑ > c
【解析】本題主要考查氫氧化鈉、金屬鋁等物質的性質。
(1)化合物甲是氫氧化鈉,甲的組成元素X、Z、Q分別是氫、氧、鈉,Q的離子結構示意圖為![]() 。
。
(2)Y元素的單質及其化合物能發生如上圖所示的轉化,則Y元素為C。在甲溶液中通入足量YZ2氣體,該反應的離子方程式:CO2+OH-===HCO![]() 。
。
(3)R是氯,乙是鹽酸,W的單質既能與甲溶液反應,又能與乙溶液反應,說明W是鋁。
①常溫下,將W的單質和甲溶液混合,發生反應的離子方程式為2Al+2OH-+2H2O===2AlO![]() +3H2↑。
+3H2↑。
②Q、W兩種元素金屬性的強弱為Q>W,下列表述中能證明這一事實的是c。a.與Q、W兩種元素金屬性的強弱沒有關系;b.與Q、W兩種元素金屬性的強弱沒有直接關系;c.證明Q、W兩種元素金屬性的強弱為Q>W。故選c。


科目:高中化學 來源: 題型:
【題目】下列事實、離子方程式及其對應關系均正確的是
A. 鐵溶于稀硝酸,溶液變為淺綠色:Fe+4H++NO3-=Fe3++NO↑+2H2O
B. 向淀粉碘化鉀溶液中滴加稀硫酸,在空氣中放置一段時間后溶液變藍:4H++4I-+O2=2I2+2H2O
C. 向![]() 溶液中滴加少量濃
溶液中滴加少量濃![]() ,溶液變為黃色:Cr2O72-(橙色)+H2O
,溶液變為黃色:Cr2O72-(橙色)+H2O![]() 2CrO42-(黃色)+2H+
2CrO42-(黃色)+2H+
D. 向水楊酸(![]() )中滴加
)中滴加![]() 溶液,放出無色氣體:
溶液,放出無色氣體:![]() +2HCO3-→
+2HCO3-→![]() +2CO2↑+2H2O
+2CO2↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下圖所示裝置可以將溫室氣體![]() 轉化為燃料氣體CO。下列說法正確的是
轉化為燃料氣體CO。下列說法正確的是
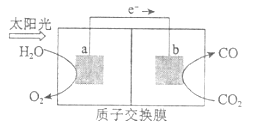
A. 該過程是將太陽能轉化為化學能的過程
B. 電極a表面發生還原反應
C. 該裝置工作時, ![]() 從b極區向a極區移動
從b極區向a極區移動
D. 該裝置中每生成![]() ,同時生成
,同時生成![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,可逆反應A+BmC變化如圖所示.已知縱坐標表示在不同溫度和壓強下生成物C在混合物中的質量分數,p為反應在T2溫度時達到平衡后向容器加壓的變化情況,問: 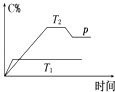
(1)溫度T1T2(填“大于”“等于”或“小于”).
(2)正反應是反應(填“吸熱”或“放熱”).
(3)如果A、B、C均為氣體,則m2(填“大于”“等于”或“小于”).
(4)當溫度和容積不變時,如在平衡體系中加入一定量的某稀有氣體,則體系的壓強(填“增大”“減小”或“不變”),平衡移動(填“向正反應方向”“向逆反應方向”或“不”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗:①![]()
![]() 溶液和
溶液和![]() 溶液各1mL混合得到紅色溶液a,均分溶液a置于b、c兩支試管中;
溶液各1mL混合得到紅色溶液a,均分溶液a置于b、c兩支試管中;
②向b中滴加3滴飽和![]() 溶液,溶液顏色加深;
溶液,溶液顏色加深;
③再向上述b溶液中滴加3滴![]() 溶液,溶液顏色變淺且出現渾濁;
溶液,溶液顏色變淺且出現渾濁;
④向c中逐漸滴加![]() 溶液
溶液![]() ,溶液顏色先變深后變淺。
,溶液顏色先變深后變淺。
下列分析不正確的是
A. 實驗②中增大![]() 濃度使平衡
濃度使平衡![]() 正向移動
正向移動
B. 實驗③中發生反應: ![]()
C. 實驗③和④中溶液顏色變淺的原因相同
D. 實驗②、③、④均可說明濃度改變對平衡移動的影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】你認為下列說法不正確的是( )
A.氫鍵存在于分子之間,不存在于分子之內
B.對于組成和結構相似的分子,其范德華力隨著相對分子質量的增大而增大
C.NH3極易溶于水而CH4難溶于水的原因只是NH3是極性分子,CH4是非極性分子
D.冰熔化時只破壞分子間作用力
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素在周期表中的位置,反映了元素的原子結構和元素的性質。如圖是元素周期表的一部分。
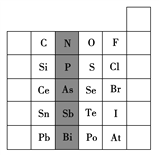
(1)陰影部分元素N在元素周期表中的位置為____周期第____族。根據元素周期律,預測酸性強弱:H3AsO4____H3PO4(填“>”或“<”)。
(2)S的最高化合價和最低化合價的代數和為____,在一定條件下,S與H2反應有一定限度(可理解為反應進行的程度),請判斷:在相同條件下Se與H2反應的程度比S與H2反應程度____(填“更大”“更小”或“相同”)。
(3)Br2具有較強的氧化性,SO2具有較強的還原性,將SO2氣體通入溴水后,溶液中存在的主要離子是____。
(4)下列說法錯誤的是____(填序號)。
①C、N、O、F的原子半徑隨著原子序數的增大而減小
②Si、P、S、Cl元素的非金屬性隨著核電荷數的增加而增強
③干冰升華、液態水轉變為氣態水都要克服分子內的共價鍵
④HF、HCl、HBr、HI的熱穩定性依次減弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各圖與表述一致的是( )
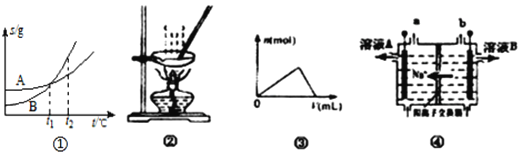
A. 圖①表示A、B兩物質的溶解度隨溫度變化情況,將t1℃時A、B飽和溶液分別升溫至t2℃時,溶質的質量分數B>A
B. 用圖②所示裝置蒸發FeCl3溶液制備無水FeCl3
C. 圖③可以表示向一定量的明礬溶液中逐滴滴加一定濃度氫氧化鋇溶液時產生Al(OH)3沉淀的物質的量變化
D. 圖④電解飽和食鹽水的裝置中,溶液B為濃氫氧化鈉溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E是元素周期表中前四周期中五種常見元素,其相關信息如表:
元素 | 相關信息 |
A | 原子核外L層電子數是K層的2倍 |
B | 其一種單質被稱為地球生物的“保護傘” |
C | 元素的第一電離能是第3周期所有元素中最小的 |
D | 基態原子最外層電子排布為(n+1)sn(n+1)p(n+2) |
E | 可形成多種氧化物,其中一種為具有磁性的黑色晶體 |
請回答下列問題:
(1)C在元素周期表中位于第周期、第族;D的基態原子核外電子排布式是 .
(2)B、C、D的簡單離子半徑由大到小的順序為(用化學符號表示,下同) , B、D的簡單氫化物中穩定性較大的是 .
(3)B的常見單質和C的單質按物質的量比1:2反應生成的化合物中化學鍵的類型為;該化合物屬于晶體.
(4)E形成的黑色磁性晶體發生鋁熱反應的化學方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
處理含AB、DB2煙道氣污染的一種方法是將其在催化劑作用下轉化為固態單質D,請寫出此反應的熱化學方程式: .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com