
【題目】2019年12月4日“全球碳計劃”發布報告說,全球CO2排放量增速趨緩。人們還需要更有力的政策來逐步淘汰化石燃料的使用。CO2的綜合利用是解決溫室問題的有效途徑。
(1)一種途徑是用CO2轉化為成為有機物實現碳循環。如:
C2H4(g)+H2O(l) ![]() C2H5OH(l) ΔH=-44.2kJ·mol-1
C2H5OH(l) ΔH=-44.2kJ·mol-1
2CO2(g)+2H2O(l) ![]() C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
已知2CO2(g)+3H2O(l) ![]() C2H5OH(l)+3O2(g)其正反應的活化能為EakJ·mol-1,則逆反應的活化能為___kJ·mol-1。乙烯與HCl加成生成的氯乙烷在堿性條件下水解也得到乙醇,反應的離子方程式為___,v=kcm(CH3CH2Cl)cn(OH-)為速率方程,研究表明,CH3CH2Cl濃度減半,反應速率減半,而OH-濃度減半對反應速率沒有影響,則反應速率方程式為___。
C2H5OH(l)+3O2(g)其正反應的活化能為EakJ·mol-1,則逆反應的活化能為___kJ·mol-1。乙烯與HCl加成生成的氯乙烷在堿性條件下水解也得到乙醇,反應的離子方程式為___,v=kcm(CH3CH2Cl)cn(OH-)為速率方程,研究表明,CH3CH2Cl濃度減半,反應速率減半,而OH-濃度減半對反應速率沒有影響,則反應速率方程式為___。
(2)利用工業廢氣中的CO2可以制取甲醇和水蒸氣,一定條件下,往2L恒容密閉容器中充入1molCO2和3molH2,在不同催化劑作用下發生反應I、反應II與反應III,相同時間內CO2的轉化率隨溫度變化如圖所示:
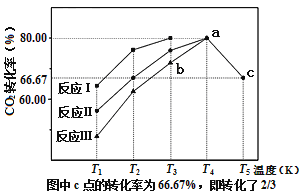
①催化劑效果最佳的反應是___(填“反應I”,“反應II”,“反應III”)。
②b點v(正)___v(逆)(填“>”,“<”,“=”)。
③若此反應在a點時已達平衡狀態,a點的轉化率比c點高的原因是___。
④c點時該反應的平衡常數K=___。
(3)中國科學家首次用CO2高效合成乙酸,其反應路徑如圖所示:
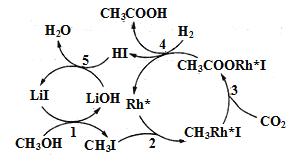
①原料中的CH3OH可通過電解法由CO2制取,用稀硫酸作電解質溶液,寫出生成CH3OH的電極反應式___。
②根據圖示,寫出總反應的化學方程式:___。
【答案】Ea-1366.8 CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq) v=kc(CH3CH2Cl) 反應I > 該反應為放熱反應,溫度升高,平衡逆向移動 ![]() CO2+6e-+6H+=CH3OH+H2O CH3OH+CO2+H2
CO2+6e-+6H+=CH3OH+H2O CH3OH+CO2+H2![]() CH3COOH+H2O
CH3COOH+H2O
【解析】
(1)應用蓋斯定律,計算出2CO2(g)+3H2O(l)![]() C2H5OH(l)+3O2(g)的ΔH,并按照ΔH=正反應的活化能-逆反應的活化能,計算逆反應的活化能,氯乙烷在堿性條件下水解得到乙醇和氯化鈉,據此寫反應的離子方程式,按反應物濃度對速率的影響數據,寫反應速率方程式即可;
C2H5OH(l)+3O2(g)的ΔH,并按照ΔH=正反應的活化能-逆反應的活化能,計算逆反應的活化能,氯乙烷在堿性條件下水解得到乙醇和氯化鈉,據此寫反應的離子方程式,按反應物濃度對速率的影響數據,寫反應速率方程式即可;
(2)一定條件下,往2L恒容密閉容器中充入1molCO2和3molH2后反應得到甲醇和水蒸氣,反應方程式為![]() ,按照CO2的轉化率隨溫度變化關系圖分析、計算回答即可;
,按照CO2的轉化率隨溫度變化關系圖分析、計算回答即可;
(3)①原料中的CH3OH可通過電解法由CO2制取,二氧化碳在陰極反應,故是二氧化碳得電子被還原的反應,據此寫生成CH3OH的電極反應式;
②根據圖示,找出總的反應物、催化劑和產物,據此寫總反應的化學方程式;
(1)反應①C2H4(g)+H2O(l)![]() C2H5OH(l) ΔH1=-44.2kJ·mol-1
C2H5OH(l) ΔH1=-44.2kJ·mol-1
反應②2CO2(g)+2H2O(l)![]() C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
應用蓋斯定律,反應①+反應②得到:2CO2(g)+3H2O(l)![]() C2H5OH(l)+3O2(g),則該反應的ΔH=ΔH1+ΔH2,故ΔH =-44.2kJ·mol-1+(+1411.0kJ·mol-1)=+1366.8kJ·mol-1,因為ΔH=正反應的活化能-逆反應的活化能,正反應的活化能為EakJ·mol-1,則逆反應的活化能為Ea-1366.8kJ·mol-1;
C2H5OH(l)+3O2(g),則該反應的ΔH=ΔH1+ΔH2,故ΔH =-44.2kJ·mol-1+(+1411.0kJ·mol-1)=+1366.8kJ·mol-1,因為ΔH=正反應的活化能-逆反應的活化能,正反應的活化能為EakJ·mol-1,則逆反應的活化能為Ea-1366.8kJ·mol-1;
答案為:Ea-1366.8;
氯乙烷在堿性條件下水解得到乙醇和氯化鈉,則反應的離子方程式為CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq);該反應的速率方程為v=kcm(CH3CH2Cl)cn(OH-),研究表明,CH3CH2Cl濃度減半,反應速率減半,則可知m=1,而OH-濃度減半對反應速率沒有影響,則n=0,故反應速率方程式為v=kc(CH3CH2Cl);
答案為:CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq);v=kc(CH3CH2Cl);
(2)一定條件下,密閉容器中發生的反應為![]() ,①相同溫度下相同時間內CO2轉化率最高的是反應Ⅰ的圖線,故最佳催化劑為反應I;
,①相同溫度下相同時間內CO2轉化率最高的是反應Ⅰ的圖線,故最佳催化劑為反應I;
答案為:反應I;
②圖線中b點未達到平衡狀態,則v(正) >v(逆);
答案為:>;
③若此反應在a點時已達平衡狀態,則繼續升溫就會使平衡移動,故a點的轉化率比c點高的原因為該反應為放熱反應,溫度升高,平衡逆向移動;
答案為:該反應為放熱反應,溫度升高,平衡逆向移動;
④該條件下,一開始往2L恒容密閉容器中充入1molCO2和3molH2,由圖知,c點時二氧化碳轉化了![]() ,則
,則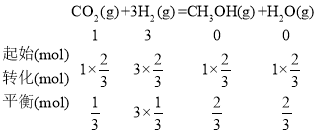 ,平衡時2L容器內
,平衡時2L容器內![]() 的濃度依次為
的濃度依次為![]() ,則該反應的平衡常數
,則該反應的平衡常數![]() =
=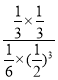 =
=![]() ;
;
答案為: ![]() ;
;
(3)①通過電解法由CO2制取CH3OH,碳元素化合價降低,故是二氧化碳得電子被還原的反應,故二氧化碳在陰極反應,則生成CH3OH的電極反應式為CO2+6e-+6H+=CH3OH+H2O;
②根據圖示,CH3OH、CO2和H2在LiI、Rh+催化作用下生產CH3COOH和H2O,總反應的化學方程式為CH3OH+CO2+H2![]() CH3COOH+H2O;
CH3COOH+H2O;
答案為:CO2+6e-+6H+=CH3OH+H2O;CH3OH+CO2+H2![]() CH3COOH+H2O。
CH3COOH+H2O。


 智趣寒假作業云南科技出版社系列答案
智趣寒假作業云南科技出版社系列答案科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G均為有機物,其中A常用來衡量一個國家石油化工發展水平的標志性物質,它們之間有如下轉化關系。
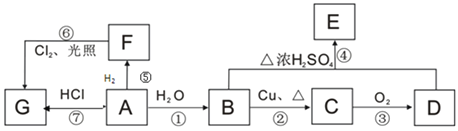
已知:![]() ,請回答下列問題:
,請回答下列問題:
(1)B、D中官能團的名稱:B____________,D________________。
(2)指出下列編號對應反應的反應類型:①____________,⑥_____________。
(3)在F的同系物中最簡單的有機物的空間構型為___________,電子式為____________。
(4)寫出與E含有相同官能團(不含E)的所有同分異構體的結構簡式:_________。
(5)寫出下列編號對應反應的化學反應方程式:
②_______________________;
④______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Mg-H2O2電池可用于驅動無人駕駛的潛航器。該電池以海水為電解質溶液,示意圖如下。該電池工作時,下列說法正確的是( )

A. Mg 電極是該電池的正極
B. H2O2在石墨電極上發生氧化反應
C. 石墨電極附近溶液的pH 增大
D. 溶液中Cl-向正極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用AgNO3溶液分別滴定濃度均為0.01molL-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡圖像如圖所示(不考慮C2O![]() 的水解)。已知Ksp(AgCl)數量級為10-10。下列敘述不正確的是( )
的水解)。已知Ksp(AgCl)數量級為10-10。下列敘述不正確的是( )
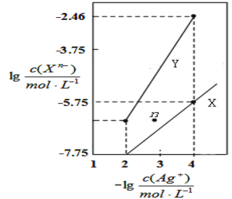
A.Ksp(Ag2C2O4)數量級為10-11
B.n點表示Ag2C2O4的過飽和溶液
C.向c(Cl-)=c(C2O![]() )的混合液中滴入AgNO3溶液時,先生成AgCl沉淀
)的混合液中滴入AgNO3溶液時,先生成AgCl沉淀
D.Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O
2AgCl(s)+C2O![]() (aq)的平衡常數為10-0.71
(aq)的平衡常數為10-0.71
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把0.4molX氣體和0.6molY氣體混合于2L密閉容器中,使它們發生如下反應:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若測知以Z的濃度變化表示的反應速率為0.05mol/(L·min),試計算
nZ(g)+6W(g)。2min末已生成0.3molW,若測知以Z的濃度變化表示的反應速率為0.05mol/(L·min),試計算
(1)前2min內用W的濃度變化表示的平均反應速率為_______________。
(2)2min末時Y的濃度為_____________________________。
(3)化學反應方程式中n=_____________________________。
(4)2min末,恢復到反應前溫度,體系內壓強是反應前壓強的__________倍。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將氣體A、B置于固定容積為2 L的密閉容器中,發生如下反應:3A(g)+B(g)2C(g)+2D(g),反應進行到10 s末,達到平衡,測得A的物質的量為1.8 mol,B的物質的量為0.6 mol,C的物質的量為0.8 mol。
(1)用C表示10 s內反應的平均反應速率為________。
(2)反應前A的物質的量濃度是________。
(3)10 s末,生成物D的濃度為________。
(4)A與B的平衡轉化率之比為________。
(5)反應過程中容器內氣體的平均相對分子質量變化是________(填“增大”、“減小”或“不變”,下同),氣體的密度變化是________。
(6)平衡后,若改變下列條件,生成D的速率如何變化(填“增大”、“減小”或“不變”):①降低溫度______;②增大A的濃度________;③恒容下充入氖氣_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以葡萄糖為原料制得的山梨醇(A)和異山梨醇(B)都是重要的生物質轉化平臺化合物。E是一種治療心絞痛的藥物,由葡萄糖為原料合成E的過程如下:

回答下列問題:
(1)葡萄糖的分子式為__________。
(2)A中含有的官能團的名稱為__________。
(3)由B到C的反應類型為__________。
(4)C的結構簡式為__________。
(5)由D到E的反應方程式為______________。
(6)F是B的同分異構體,7.30 g的F與足量飽和碳酸氫鈉反應可釋放出2.24 L二氧化碳(標準狀況),F的可能結構共有________種(不考慮立體異構),其中核磁共振氫譜為三組峰,峰面積比為3∶1∶1的結構簡式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應H2(g)+Cl2(g)=2HCl(g)的能量變化如圖所示,則下列說法中正確的是
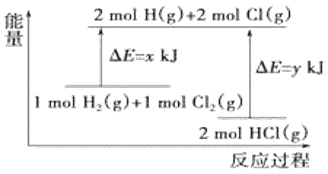
A.該反應是吸熱反應
B.斷裂1molH-H鍵和1molCl-Cl鍵時能放出x kJ的能量
C.斷裂2molH-Cl鍵時需要吸收y kJ的能量
D.2molHCl(g)的總能量高于1molH2(g)和1molCl2(g)的總能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學對未知物A鹽的水溶液進行了鑒定,實驗過程及現象如圖所示:

已知硝酸能將Fe2+氧化為Fe3+。回答下列問題:
(1) A可能是________________;
(2) B的化學式是______________,D的化學式是____________;
(3)濾液C中一定含有的陽離子Fe3+是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com