
| 混合組別 | 混合前酸或鹽的總濃度 | 混合比例及混合溶液性質(zhì) |
| A | c(HA)=0.02mol?L-1 | 等體積混合,pH>7 |
| B | HB溶液的pH=2 | V1 mL NaOH溶液與V2 mL HB溶液,pH=7 |
| C | c(H2C)=0.01mol?L-1 | 等體積混合,pH>7 |
| D | c(NaHD)=0.01mol?L-1 | 等體積混合,pH=7 |
| 1000 |
| 18 |
| 1000 |
| 18 |
| 10-12 | ||
|


 仁愛(ài)英語(yǔ)同步練習(xí)冊(cè)系列答案
仁愛(ài)英語(yǔ)同步練習(xí)冊(cè)系列答案 學(xué)習(xí)實(shí)踐園地系列答案
學(xué)習(xí)實(shí)踐園地系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
| 酸或堿 | 電離平衡常數(shù)(Ka或Kb) |
| CH3COOH | 1.8×10-3 |
| HNO3 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2013-2014學(xué)年福建省龍巖市高三上學(xué)期期末考試化學(xué)試卷(解析版) 題型:填空題
X、Y、Z、W分別是HNO3、NH4NO3、NaOH、NaNO2四種強(qiáng)電解質(zhì)中的一種。下表是常溫下濃度均為0.0 1 mol·L-1的X、Y、Z、W溶液的pH。
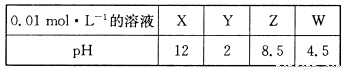
(1)X、W的化學(xué)式分別為_(kāi)______、________。
(2)W的電離方程式為_(kāi)_____________________________。
(3)25℃時(shí),Z溶液的pH>7的原因是______________________________________(用離子方程式表示)。
(4)將X、Y、Z各1mol·L-1同時(shí)溶于水中制得混合溶液,則混合溶液中各離子的濃度由大到小的順序?yàn)?_______________________________________________________ 。
(5)Z溶液與W溶液混合加熱,可產(chǎn)生一種無(wú)色無(wú)味的單質(zhì)氣體,該反應(yīng)的化學(xué)方程式為_(kāi)_________________________________________________________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:不詳 題型:填空題
| 混合組別 | 混合前酸或鹽的總濃度 | 混合比例及混合溶液性質(zhì) |
| A | c(HA)=0.02mol-L-1 | 等體積混合,pH>7 |
| B | HB溶液的pH=2 | V1 mL NaOH溶液與V2 mL HB溶液,pH=7 |
| C | c(H2C)=0.01mol-L-1 | 等體積混合,pH>7 |
| D | c(NaHD)=0.01mol-L-1 | 等體積混合,pH=7 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2012-2013學(xué)年江西省吉安市吉州區(qū)白鷺洲中學(xué)高二(上)期中化學(xué)試卷(理科)(解析版) 題型:填空題
| 混合組別 | 混合前酸或鹽的總濃度 | 混合比例及混合溶液性質(zhì) |
| A | c(HA)=0.02mol?L-1 | 等體積混合,pH>7 |
| B | HB溶液的pH=2 | V1 mL NaOH溶液與V2 mL HB溶液,pH=7 |
| C | c(H2C)=0.01mol?L-1 | 等體積混合,pH>7 |
| D | c(NaHD)=0.01mol?L-1 | 等體積混合,pH=7 |
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com