
工業上,將黃銅礦(CuFeS2)通過8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2反應制取銅及其硫和鐵的化合物。
8Cu+4FeO+2Fe2O3+16SO2反應制取銅及其硫和鐵的化合物。
(1)上述反應中,還原劑為 。
(2)黃銅礦冶煉銅產生的爐渣(含Fe2O3、FeO、SiO2、Al2O3)可制備Fe2O3。方法為:
①用稀鹽酸浸取爐渣,過濾。
②濾液先氧化,再加入過量NaOH溶液,過濾,將沉淀洗滌、干燥、煅燒得Fe2O3。
據以上信息回答下列問題:
a.通過上述②,爐渣中的Al2O3變成了 (寫離子)。
b.選用提供的試劑,設計實驗驗證爐渣中含有FeO。
提供的試劑:稀鹽酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水
所選試劑為 。
證明爐渣中含有FeO的實驗現象為 。
(3)對上述爐渣中進行含鐵量的測定步驟如下:
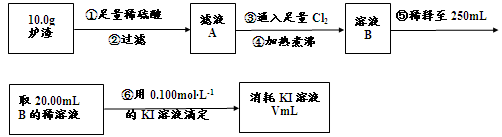
I.步驟③發生反應的離子方程式為 。
II.步驟④中煮沸的作用是 。
III.步驟⑤中用到的玻璃儀器有燒杯、玻璃棒、膠頭滴管、 。
IV.若滴定過程中消耗0.100mol·L−1KI溶液20.00mL,則爐渣中鐵的百分含量為 。
(1)CuFeS2 (2)a.[Al(OH)4]- 或AlO2- b.稀硫酸、酸性KMnO4溶液;稀硫酸浸取爐渣所得溶液使酸性KMnO4溶液褪色(3)I.2Fe2++Cl2= 2Fe3++2Cl-II.趕走溶液中溶解的過量的Cl2 III.250mL容量瓶 (未答“250mL”不給分)IV.14%
【解析】
試題分析:(1)在反應中CuFeS2中鐵元素的化合價由+2價變為+3價,硫元素的化合價由-2價變為+4價做還原劑;(2)①用稀鹽酸浸取爐渣發生的反應為:Al2O3 + 6H+=2Al3+ + 3H2O
FeO + 2H+ = Fe2+ + H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O ②濾液中含有的金屬陽離子有Al3+、Fe2+ 和Fe3+,氧化后含有Al3+和Fe3+,加過量氫氧化鈉溶液發生的反應:Al3+ + 4OH-=AlO2- + 2H2O Fe3+ + 3OH- = Fe(OH)3↓ a、通過上述②,爐渣中的Al2O3變成了AlO2- ;b驗證爐渣中含有+2價的鐵,應先加入稀硫酸溶解,生成亞鐵離子,具有還原性,可與高錳酸鉀發生氧化還原反應,酸化時不能加入鹽酸,否則與高錳酸鉀發生氧化還原反應,也不能直接加入硝酸,否則生成鐵離子,不能檢驗,故答案為:稀硫酸、KMnO4溶液;稀硫酸浸取爐渣所得溶液含有亞鐵離子,與高錳酸鉀發生氧化還原反應而使高錳酸鉀褪色,故答案為:稀硫酸浸取爐渣所得溶液能使KMnO4溶液褪色;(3)分析工藝流程圖發生的反應為:爐渣加足量稀硫酸:Al2O3 + 6H+=2Al3+ + 3H2O FeO + 2H+ = Fe2+ + H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O過濾,濾液中含有的金屬陽離子有Al3+、Fe2+ 和Fe3+,通入足量Cl2:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 滴定原理:2Fe3+ + 2I- = 2Fe2+ + I2I.步驟③通入足量氯氣發生反應的離子方程式為2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ;II.過量的氯氣能氧化I-,會影響實驗結果,所以步驟④中煮沸的作用是趕走溶液中溶解的過量的Cl2;。III.步驟⑤為溶液的配制,用到的玻璃儀器有燒杯、玻璃棒、膠頭滴管、250mL容量瓶。IV.滴定過程中發生的反應為2Fe3+ + 2I- = 2Fe2+ + I2,由反應式知n(I-)= n(Fe3+)=0.002mol,結合流程圖知10.0g爐渣中鐵的物質的量為0.025mol,質量為1.4g,質量分數為14%。
考點:以化學工藝流程為載體考查氧化還原反應基本概念、鐵和鋁的化合物的性質、溶液的配制以及關系式法計算。


科目:高中化學 來源: 題型:閱讀理解
| Ksp | 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
| ||
| ||
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2013-2014學年福建省泉州市高三質檢理綜化學試卷(解析版) 題型:填空題
工業上以黃銅礦(主要成分CuFeS2)為原料制備金屬銅,有如下兩種工藝。
I.火法熔煉工藝:將處理過的黃銅礦加人石英,再通人空氣進行焙燒,即可制得粗銅。
(1)焙燒的總反應式可表示為:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSi03+4SO2該反應的氧化劑是_____。
(2)下列處理SO2的方法,不合理的是_____
A.高空排放
B.用純堿溶液吸收制備亞硫酸鈉
C.用氨水吸收后,再經氧化制備硫酸銨
D.用BaCl2溶液吸收制備BaSO3
(3)爐渣主要成分有FeO 、Fe2O3 、SiO2 ,Al2O3等,為得到Fe2O3加鹽酸溶解后,后續處理過程中,未涉及到的操作有_____。
A過濾;B加過量NaOH溶液;C蒸發結晶;D灼燒;E加氧化劑
II.FeCl3溶液浸取工藝:其生產流程如下圖所示

(4)浸出過程中,CuFeS2與FeCl3溶液反應的離子方程式為? _____________。
(5)該工藝流程中,可以循環利用的物質是_____(填化學式)。
(6)若用石墨電極電解濾液,寫出陽極的電極反式_____________。
(7)黃銅礦中含少量Pb,調節C1一濃度可控制濾液中Pb2+的濃度,當c(C1一)=2mo1·L-1時溶液中Pb2+物質的量濃度為__mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com