
【題目】某化學小組用如圖所示裝置驗證鹵素單質氧化性的相對強弱。下列說法不正確的是( )
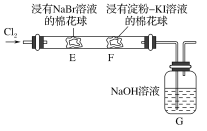
A.E處棉花球變成黃色,說明Cl2的氧化性比Br2強
B.F處棉花球變成藍色,說明Br2的氧化性比I2強
C.E處發生反應的離子方程式為:Cl2+2Br-===2Cl-+Br2
D.G裝置中NaOH溶液與Cl2反應的離子方程式為:2OH-+Cl2===ClO-+Cl-+H2O
科目:高中化學 來源: 題型:
【題目】磷酸是重要的化學試劑和工業原料。請回答下列問題:
(1)已知:25℃時,磷酸和氫氟酸的電離常數如下表所示。
物質 | H3PO4 | HF |
電離常數 | Ka1=7.1×103; Ka2=6.3×108; Ka3=4.2×1013 | Ka=6.6×104 |
向NaF溶液中滴加少量H3PO4溶液,反應的離子方程式為____________
(2)已知:
Ⅰ.CaO(s)+H2SO4(l)![]() CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)![]() Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
則:①工業上用Ca5(PO4)3F和硫酸反應制備磷酸的熱化學方程式為____________。
②一定條件下,在密閉容器中只發生反應Ⅱ,達到平衡后縮小容器容積,HF的平衡轉化率________(填“增大”“減小”或“不變”,下同);HF的平衡濃度________。
(3)工業上用磷尾礦制備Ca5(PO4)3F時生成的副產物CO可用于制備H2,原理為CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH。
CO2(g)+H2(g) ΔH。
①一定溫度下,向10L密閉容器中充入0.5mol CO和1mol H2O(g),2min達到平衡時,測得0~2min內用CO2表示的反應速率v(CO2)=0.02mol·L1·min1。則CO的平衡轉化率α=________;該反應的平衡常數K=________。
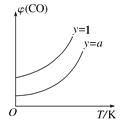
②在壓強不變的密閉容器中發生上述反應,設起始的![]() =y,CO的平衡體積分數(φ)與溫度(T)的關系如圖所示。則:該反應的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由為_____________
=y,CO的平衡體積分數(φ)與溫度(T)的關系如圖所示。則:該反應的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由為_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學利用下圖進行噴泉實驗,已知圓底燒瓶內充滿X氣體,膠頭滴管內裝有少量Y液體,燒杯內裝有足量Z液體,下列組合能進行噴泉實驗且最終液體一定能充滿整個燒瓶的是( )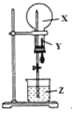
X氣體 | Y試劑 | Z試劑 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 飽和食鹽水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:常溫下, ![]() 。現有1L 0.1mol·L-1的兩種溶液:①NaClO溶液;② NaF溶液。下列說法正確的是
。現有1L 0.1mol·L-1的兩種溶液:①NaClO溶液;② NaF溶液。下列說法正確的是
A. c(H+):①>②
B. 分別加入1L 0.1mol·L-1HCl溶液后,兩溶液的pH:①<②
C. 分別加入等濃度的鹽酸至溶液呈中性,消耗鹽酸的體積:①<②
D. n(HF)+n(F-)=n(HClO)+n(ClO-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰氯(NOCl)是有機合成中的重要試劑,可由一氧化氮與氯氣在常溫常壓下合成。已知NOCl是一種紅褐色液體或黃色氣體,其熔點是-64.5℃,沸點是-5.5℃,遇水易水解。回答下列問題:
(1)實驗室制備原料氣NO和Cl2的裝置如下圖所示。

①實驗室制NO時,裝置A中燒瓶內發生反應的化學方程式為______________。
②實驗室制Cl2時,裝置B的作用是______________________。
(2)將上述收集到的Cl2充入集氣瓶中,按圖示裝置制備亞硝酰氯。
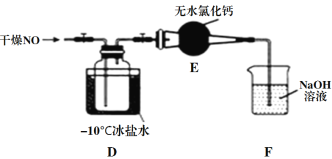
①NOCl分子中各原子均滿足8電子穩定結構,則NOCl的電子式為_____________。
②裝置D中的現象為_____________________________________________。
③裝置E中無水氯化鈣的作用為_______________________________。
④某同學認為裝置F不能吸收NO,為解決這一問題,可將尾氣與某種氣體同時通入氫氧化鈉溶液中,這種氣體的化學式是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鉀(K2FeO4)是一新型、高效、無毒的多功能水處理劑。制備K2FeO4如下圖:查閱資料:K2FeO4為紫色固體,微溶于KOH溶液,具有強氧化性,在酸性或中性溶液中快速產生O2,在堿性溶液中較穩定。
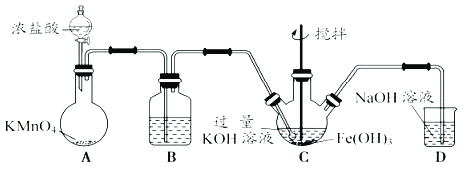
(1)A為制取氯氣發生裝置,其中盛放濃鹽酸的儀器名稱為______,A中化學反應的還原劑是______。
(2)裝置B的作用是除雜,所用試劑為___________。
(3)C為制備K2FeO4裝置,KOH溶液過量的原因是_________________________。
(4)D為尾氣處理裝置,發生反應的離子方程式為___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化硅(Si3N4)是一種重要的結構陶瓷材料,屬于新型功能性陶瓷產品,它的硬度大、熔點高、化學性質穩定,工業上曾普遍采用高純硅與純氮在1300℃時反應獲得。
(1)氮化硅陶瓷抗腐蝕能力強,除氫氟酸外,它不與其他無機酸反應。試推測該陶瓷被氫氟酸腐蝕的化學方程式:_________。
(2)現用四氧化硅和氮氣在氫氣氣氛保護下,加強熱發生反應,可得較高純度的氮化硅及氯化氫,反應的化學方程式為____。
(3)沸石是一種含結晶水的、具有多孔結構的鋁硅酸鹽,化學式為Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國盛產山茶籽精油,其主要成分檸檬醛可以合成具有工業價值的β—紫羅蘭酮。

(1)要檢驗檸檬醛中含有碳碳雙鍵,需要使用下列試劑中的________(按反應順序填試劑序號)。
A.氫氧化鈉溶液 B.酸性高錳酸鉀溶液
C.銀氨溶液 D.碳酸鈉溶液
(2)寫出檸檬醛和新制氫氧化銅反應的化學方程式__________ 。
(3)檸檬醛有多種同分異構體,能滿足下列條件的同分異構體有________ 種。
A.含有一個![]() 的六元環結構,六元環上只有一個取代基
的六元環結構,六元環上只有一個取代基
B.能發生銀鏡反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知一定溫度時:2SO2(g)+O2(g)![]() 2SO3(g),當生成2mol SO3時,放出熱量197kJ,在相同溫度和壓強下,向密閉容器中通入2mol SO2和1molO2,達到平衡時放出熱量Q,則下列關系式中正確的是
2SO3(g),當生成2mol SO3時,放出熱量197kJ,在相同溫度和壓強下,向密閉容器中通入2mol SO2和1molO2,達到平衡時放出熱量Q,則下列關系式中正確的是
A.Q=197 kJ B.Q<197×2 kJ C.Q<197 kJ D.Q>197 kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com