
[化學選修——5:有機化學基礎](15分)立方烷(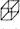 )具有高度的對稱性.高致密性.高張力能及高穩定性等特點,因此合成立方烷及其衍生物成為化學界關注的熱點。下面是立方烷衍生物I的一種合成路線:
)具有高度的對稱性.高致密性.高張力能及高穩定性等特點,因此合成立方烷及其衍生物成為化學界關注的熱點。下面是立方烷衍生物I的一種合成路線:
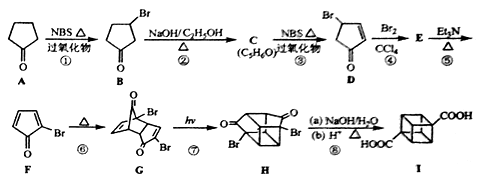
回答下列問題:
(1)C的結構簡式為 ,E的結構簡式為 。
(2)③的反應類型為 ,⑤的反應類型為
(3)化合物A可由環戊烷經三步反應合成:
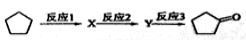
反應1的試劑與條件為 ;反應2的化學方程式為 ;反應3可用的試劑為 。
(4)在I的合成路線中,互為同分異構體的化合物是 (填化合物代號)。
(5)I與堿石灰共熱可轉化為立方烷。立方烷的核磁共振氫譜中有 個峰。
(6)立方烷經硝化可得到六硝基立方烷,其可能的結構有 種。
科目:高中化學 來源:2016屆重慶市高三上學期開學考試化學試卷(解析版) 題型:實驗題
(14分)鈰、鉻、鈦、鎳雖不是中學階段常見的金屬元素,但在工業生產中有著重要作用。
(1)二氧化鈰 (CeO2)在平板電視顯示屏中有著重要應用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在該反應中作_____劑。
(2)自然界Cr主要以+3價和+6價存在。+6價的Cr能引起細胞的突變,可以用亞硫酸鈉將其還原為+3價的鉻。完成并配平下列離子方程式:
__Cr2O72-+__SO32-+__ =__Cr3++__SO42-+ __H2O
=__Cr3++__SO42-+ __H2O
(3)鈦(Ti)被譽為“二十一世紀的金屬”,工業上在550℃時用鈉與四氯化鈦反應可制得鈦,該反應的化學方程式是 。
(4)NiSO4·xH2O是一種綠色易溶于水的晶體,廣泛用于鍍鎳、電池等,可由電鍍廢渣(除鎳外,還含有銅、鋅、鐵等元素)為原料獲得。操作步驟如下:

 ①向濾液Ⅰ中加入FeS是為了除去Cu2+、Zn2+等雜質,除去Cu2+的離子方程式為__________。
①向濾液Ⅰ中加入FeS是為了除去Cu2+、Zn2+等雜質,除去Cu2+的離子方程式為__________。
②對濾液Ⅱ先加H2O2再調pH,調pH的目的是 。
③濾液Ⅲ溶質的主要成分是NiSO4,加Na2CO3過濾后,再加適量稀硫酸溶解又生成NiSO4,這兩步操作的目的是____________。
④為測定NiSO4·xH2O晶體中x的值,稱取26.3 g晶體加熱至完全失去結晶水,剩余固體15.5 g,列式計算x的值等于 。
查看答案和解析>>
科目:高中化學 來源:2016屆廣東省等六校高三第一次聯考化學試卷(解析版) 題型:選擇題
已知室溫時,0.1mo1/L某一元酸HA在水中有0.1%發生電離,下列敘述錯誤的是:
A.該溶液的pH=4
B.由HA電離出的c(H+)約為水電離出的c(H+)的106倍
C.在該溫度下加水稀釋,溶液的中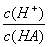 減小
減小
D.此酸的電離平衡常數約為1.0×10-7
查看答案和解析>>
科目:高中化學 來源:2015-2016學年黑龍江大慶鐵人中學高二上9月考化學試卷(解析版) 題型:填空題
(12分)硫及其化合物在工業生產中有重要的應用,它們性質的研究對工業生產有重要的指導意義。
(1)2SO2(g)+O2(g) 2SO3(g),反應過程的能量變化如圖所示。
2SO3(g),反應過程的能量變化如圖所示。
已知1 mol SO2(g)氧化為1 mol SO3(g)放出的熱量為99 kJ。請回答下列問題:
①圖中E表示_________,E的大小對該反應的反應熱有無影響?___________。該反應通常用V2O5作催化劑,加V2O5會使圖中B點升高還是降低?____________,理由是_____________;
②圖中ΔH=________kJ·mol-1;
(2)下圖表示在密閉容器中反應2SO2+O2 2SO3 達到平衡時,由于條件改變而引起反應速度和化學平衡的變化情況。
2SO3 達到平衡時,由于條件改變而引起反應速度和化學平衡的變化情況。
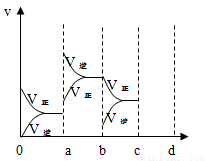
①a b過程中改變的條件可能是 ;
②b c過程中改變的條件可能是 ;
③若增大壓強時,反應速率變化情況畫在c~d處。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年北大附中河南分校高二上9月考化學試卷(解析版) 題型:選擇題
化學反應N2+3H2?2NH3的能量變化如圖所示,該反應的熱化學方程式是
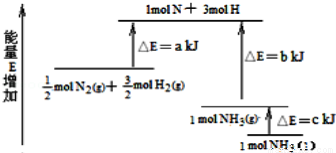
A.N2(g)+3H2(g)?2NH3(l)△H=2(a﹣b﹣c)kJ/mol
B.N2(g)+3H2(g)?2NH3(g)△H=2(b﹣a)kJ/mol
C.0.5N2(g)+1.5H2(g)?NH3(l)△H=(b+c﹣a)kJ/mol
D.0.5N2(g)+1.5H2(g)?NH3(g)△H=(a+b)kJ/mol
查看答案和解析>>
科目:高中化學 來源:2016屆四川省高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下述實驗能達到預期目的是
編號 | 實驗內容 | 實驗目的 |
A | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后紅色褪去 | 證明Na2CO3溶液中存在水解平衡 |
B | 將SO2通入酸性KMnO4 溶液中,紫色褪去 | 證明SO2具有漂白性 |
C | 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液產生白色沉淀后,再滴加2滴0.1mol/L的FeCl3溶液,又生成紅棕色沉淀 | 證明在相同溫度下,氫氧化鎂的溶解度大于氫氧化鐵的溶解度 |
D | 測定等物質的量濃度的Na2SO3與Na2CO3溶液的pH,后者較大 | 證明非金屬性S>C |
查看答案和解析>>
科目:高中化學 來源:2016屆山西省忻州市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
在CO2中,Mg燃燒生成MgO和C。下列說法正確的是
A.元素C的單質只存在金剛石和石墨兩種同素異形體
B. Mg、MgO中鎂元素微粒的半徑:r(Mg2+)>r(Mg)
C.在該反應條件下,Mg的還原性強于C的還原性
D.該反應中化學能全部轉化為熱能
查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三上學期一模化學試卷(解析版) 題型:實驗題
(14分)己知氨可以與灼熱的氧化銅反應得到氮氣和金屬銅,用示意圖中的裝置可以實現該反應。

回答下列問題:
(1)A中生成氨氣反應的化學方程式是 _________________;
(2)B中加入的干燥劑是_______(填序號)①濃硫酸②無水氯化鈣③堿石灰;
(3)能證明氨與氧化銅反應的現象:①C中______、②D中有無色液體生成;
設計實驗檢驗D中無色液含有水:取少量液體于試管中,加入少量_______粉末,現象為______。
(4)寫出氨氣與氧化銅反應的化學方程式 _______________。若收集到2.24L(STP)氮氣,計算轉移電子數為______________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年青海省高一入學化學試卷(解析版) 題型:選擇題
用 NA 表示阿伏加德羅常數的值,下列敘述正確的是
A.1molCl2 與足量 Fe 反應,轉移的電子數為 3NA
B.在常溫常壓下,1.7g NH3 含有的原子數為 0.4NA
C.標準狀況下,11.2 L 水中含有的原子數是 1.5NA
D.0.2 mol?L-1 的 Na2SO4 溶液中含 Na+數目為 0.4NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com