
 .
. .
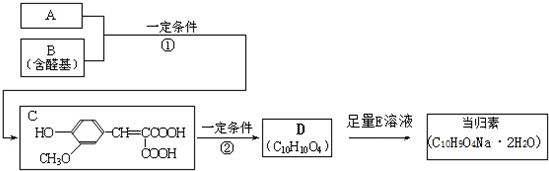
.分析 A的相對分子質量為104,1mol A與足量的碳酸氫鈉反應生成2mol二氧化碳,則A分子含有2個-COOH,去掉2個-COOH剩余總相對原子質量為104-45×2=14,剩余基團為CH2,故A的結構簡式為HOOCCH2COOH;B的結構中含有醛基,根據C結構簡式結合信息知,B為 ,C在一定條件下生成有機酸D,結合D的分子式可知,C脫去1分子二氧化碳生成D,由信息可知,D的結構簡式為
,C在一定條件下生成有機酸D,結合D的分子式可知,C脫去1分子二氧化碳生成D,由信息可知,D的結構簡式為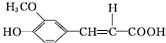 ,D與足量的E反應得到當歸素,由當歸素的分子式可知,D中羧基發生反應生成鈉鹽,故E為碳酸氫鈉,據此分析解答.
,D與足量的E反應得到當歸素,由當歸素的分子式可知,D中羧基發生反應生成鈉鹽,故E為碳酸氫鈉,據此分析解答.
解答 解:A的相對分子質量為104,1mol A與足量的碳酸氫鈉反應生成2mol二氧化碳,則A分子含有2個-COOH,去掉2個-COOH剩余總相對原子質量為104-45×2=14,剩余基團為CH2,故A的結構簡式為HOOCCH2COOH;B的結構中含有醛基,根據C結構簡式結合信息知,B為 ,C在一定條件下生成有機酸D,結合D的分子式可知,C脫去1分子二氧化碳生成D,由信息可知,D的結構簡式為
,C在一定條件下生成有機酸D,結合D的分子式可知,C脫去1分子二氧化碳生成D,由信息可知,D的結構簡式為 ,D與足量的E反應得到當歸素,由當歸素的分子式可知,D中羧基發生反應生成鈉鹽,故E為碳酸氫鈉,
,D與足量的E反應得到當歸素,由當歸素的分子式可知,D中羧基發生反應生成鈉鹽,故E為碳酸氫鈉,
(1)C和酚羥基、碳碳雙鍵,可以發生氧化反應,含有羧基,可以發生酯化反應,醚鍵很穩定,不易發生水解反應,不能發生消去反應,故選:ad;
(2)C中酚羥基和羧基都與鈉反應生成氫氣,只有羧基能和碳酸氫鈉反應生成二氧化碳,酚羥基和羧基都能與NaOH反應,所以等物質的量的C分別與足量的Na、NaHCO3、NaOH反應消耗Na、NaHCO3、NaOH的物質的量之比是3:2:3,
故答案為:3:2:3;
(3)通過以上分析知,E名稱是碳酸氫鈉,故答案為:碳酸氫鈉;
(4)在一定條件下,A和B反應生成C,反應方程式為: ,
,
故答案為: ;
;
(5)阿魏酸的同分異構體符合下列條件:
①在苯環上只有兩個取代基;
②在苯環上的一氯取代物只有兩種,說明兩個取代基處于對位位置,且兩個取代基不同或者兩個取代基處于鄰位位置,且兩個取代基相同,
③1mol該同分異構體與足量NaHCO3反應生成2mol CO2氣體,含有2個-COOH,
所以符合條件的阿魏酸的同分異構體結構簡式分別為: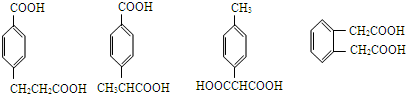 ,所以符合條件的有4種,
,所以符合條件的有4種,
故答案為:4; .
.
點評 本題全面考查了芳香烴、酸、酯的化學性質及轉化關系,同時全面考查了各種有機反應類型,如加成反應、氧化反應、酯化反應等;在解這類題目時首先要理解題目中所給信息,特別是所給信息中的斷鍵本質,這樣在做后面的題目時才能靈活運用信息解題;在學習過程中一定要掌握它們的代表物的性質,還要熟悉它們之間的相互轉化,學會能夠根據反應類型、反應條件、反應物或生成的性質進行推測.同時要掌握烴的衍生物的一些特性,這有助于快速找到解題的突破口.


 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:解答題
 (1)寫出化學式FNH3,
(1)寫出化學式FNH3,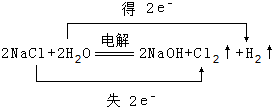 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
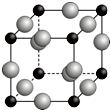 已知A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大.其中基態A原子價電子排布式為nsnnpn+1;化合物B2E為離子化合物,E原子核外的M層中只有兩對成對電子;C元素是地殼中含量最高的金屬元素;D單質常用于制作太陽能電池和集成電路芯片;F原子最外層電子數與B的相同,其余各內層軌道均充滿電子.請根據以上信息,回答下列問題(答題時,A、B、C、D、E、F用所對應的元素符號表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大.其中基態A原子價電子排布式為nsnnpn+1;化合物B2E為離子化合物,E原子核外的M層中只有兩對成對電子;C元素是地殼中含量最高的金屬元素;D單質常用于制作太陽能電池和集成電路芯片;F原子最外層電子數與B的相同,其余各內層軌道均充滿電子.請根據以上信息,回答下列問題(答題時,A、B、C、D、E、F用所對應的元素符號表示):查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 試劑 | 離子方程式 | |
| ①NaCl (Na2SO4) | ||
| ②NaCl(MgCl2) | ||
| ③NaCl(Na2CO3) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
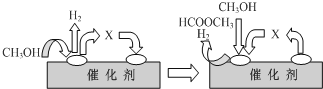
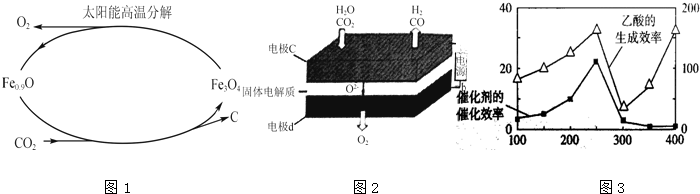
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4gNaOH固體所含電子總數為2NA | |
| B. | 22.4lL C2H6所含化學鍵總數為7 NA | |
| C. | 6g SiO2所含分子數為0.1NA,化學鍵總數為0.4 NA | |
| D. | 0.1 mol•L-1NH4Cl溶液中,NH${\;}_{4}^{+}$與Cl-數之和小于0.2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com