
 前四周期原子序數依次增大的元素A、B、C、D中,A和B的價電子層中未成對電子均只有1個,且A-和B+的電子相差為8;與B位于同一周期的C和D,它們價電子層中的未成對電子數分別為4和2,且原子序數相差為2.回答下列問題:
前四周期原子序數依次增大的元素A、B、C、D中,A和B的價電子層中未成對電子均只有1個,且A-和B+的電子相差為8;與B位于同一周期的C和D,它們價電子層中的未成對電子數分別為4和2,且原子序數相差為2.回答下列問題: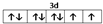 .
.分析 前四周期原子序數依次增大的元素A、B、C、D中,A和B的價電子層中未成對電子均只有一個,并且A-和B+的電子數相差為8,A屬于第VIIA族元素,B屬于第IA族元素,且A的原子序數小于B,則A是F元素,B是K元素;與B位于同一周期的C和D,它們價電子層中的未成對電子數分別為4和2,且原子序數相差為2,且C和D的原子序數大于B,C的原子序數小于D,則C是Fe元素,D是Ni元素.
解答 解:前四周期原子序數依次增大的元素A、B、C、D中,A和B的價電子層中未成對電子均只有一個,并且A-和B+的電子數相差為8,A屬于第VIIA族元素,B屬于第IA族元素,且A的原子序數小于B,則A是F元素,B是K元素;與B位于同一周期的C和D,它們價電子層中的未成對電子數分別為4和2,且原子序數相差為2,且C和D的原子序數大于B,C的原子序數小于D,則C是Fe元素,D是Ni元素,
(1)Ni2+的價層電子為3d電子,根據能量最低原理、保里不相容原理及洪特規則知,其價電子排布圖為 ,
,
故答案為: ;
;
(2)元素的金屬性越強其第一電離能越小,元素的非金屬性越強,其電負性越大,這四種元素中金屬性最強的是K元素,非金屬性最強的元素是F,所以第一電離能最小的是K,電負性最大的是F,
故答案為:K;F;
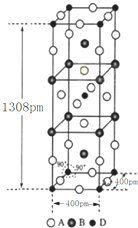
(3)①該晶胞中F原子個數=16×$\frac{1}{4}$+4×$\frac{1}{2}$+2=8,K原子個數=8×$\frac{1}{4}$+2=4,Ni原子個數=8×$\frac{1}{8}$+1=2,所以該化合物的化學式為K2NiF4,
故答案為:K2NiF4;
②該晶胞的體積=(400×10-10cm)2×(1308×10-10cm),晶胞質量=$\frac{39×4+59×2+19×8}{6.02×1{0}^{23}}$g,故晶體密度=$\frac{\frac{39×4+59×2+19×8}{6.02×1{0}^{23}}g}{(400×1{0}^{-10}cm)^{2}×1308×1{0}^{-10}cm}$=3.4g•cm-3,
故答案為:3.4;
(4)F-、K+和Fe3+三種離子組成的化合物K3FeF6,Fe3+含有空軌道,為中心離子,F-含有孤對電子,為配體,二者之間形成配位鍵,形成配離子[FeF6]3-,[FeF6]3-與K+之間形成離子鍵,
故答案為:離子鍵、配位鍵;[FeF6]3-;F-.
點評 本題考查物質結構和性質,正確推斷元素是解本題關鍵,難度中等,注意化學式的確定中各原子被幾個晶胞共用,為易錯點,難點是密度的計算.


科目:高中化學 來源: 題型:選擇題
| A. | 銅與硝酸銀溶液反應:Cu+Ag+═Cu2++Ag | |
| B. | 鐵在氯氣中燃燒:2Fe+3Cl2═2Fe3++6Cl- | |
| C. | 硫酸銅溶液中滴加氫氧化鋇溶液:SO42-+Ba2+═BaSO4↓ | |
| D. | 氧化鋁與稀鹽酸混合:Al2O3+6H+═2Al3++3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | CO2 | B. | BeCl2 | C. | BF3 | D. | XeF2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 最外層電子數:Z>R>Y | |
| B. | 氣態氫化物的穩定性:Y<Z | |
| C. | R、X的氧化物均為離子化合物 | |
| D. | X和Y兩者最高價氧化物對應的水化物能相互反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
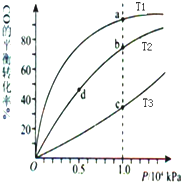
| A. | 溫度:T1>T2>T3 | B. | 平衡常數:K(a)>K(c) K(b)=K(d) | ||
| C. | 正反應速率:v(a)>v(c) v(b)>v(d) | D. | 平均摩爾質量:M(a)<M(c) M(b)>M(d) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用膠頭滴管加液時,不能伸入試管中 | |
| B. | 蒸餾盛在燒瓶中含水的酒精,需在瓶內放一些碎瓷片 | |
| C. | 萃取實驗中涉及氣體壓強原理 | |
| D. | 用容積為100 mL的量筒量取80 mL無水乙醇,使液面最低點至刻度80 mL處 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 通空氣時,銅被腐蝕,表面產生CuO | |
| B. | 放電時,Li+透過固體電解質向Cu極移動 | |
| C. | 放電時,正極的電極反應式為Cu2O+H2O+2e-═2Cu+2OH- | |
| D. | 整個反應過程中,銅相當于催化劑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com