二甲醚(DME)被譽為“21世紀的清潔燃料”.由合成氣制備二甲醚的主要原理如下:
①CO(g)+2H
2(g)?CH
3OH(g)△H
1=-90.7kJ?mol
-1②2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H
2=-23.5kJ?mol
-1③CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H
3=-41.2kJ?mol
-1回答下列問題:
(1)則反應3H
2(g)+3CO(g)?CH
3OCH
3(g)+CO
2(g)的△H=
kJ?mol
-1.
(2)下列措施中,能提高CH
3OCH
3產率的有
.
A.使用過量的CO B.升高溫度 C.增大壓強
(3)反應③能提高CH
3OCH
3的產率,原因是
.
(4)將合成氣以
=2通入1L的反應器中,一定條件下發生反應:
4H
2(g)+2CO(g)?CH
3OCH
3(g)+H
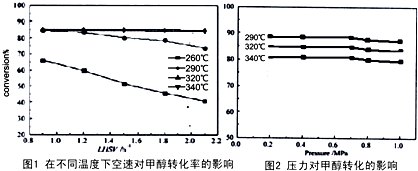
2O(g)△H,其CO的平衡轉化率隨溫度、壓強變化關系如圖1所示,下列說法正確的是
.
A.△H<0
B.P
1<P
2<P
3C.若在P
3和316℃時,起始時
=3,則達到平衡時,CO轉化率小于50%
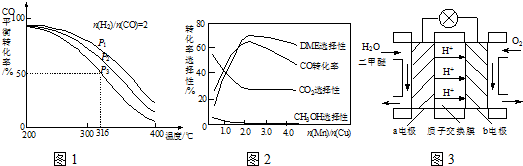
(5)采用一種新型的催化劑(主要成分是Cu-Mn的合金),利用CO和H
2制備二甲醚.觀察圖2回答問題.催化劑中
約為
時最有利于二甲醚的合成.
(6)圖3為綠色電源“二甲醚燃料電池”的工作原理示意圖,a電極的電極反應式為
.
(7)甲醇液相脫水法制二甲醚的原理是:CH
3OH+H
2SO
4→CH
3HSO
4+H
2O,CH
3HSO
4+CH
3OH→CH
3OCH
3+H
2SO
4.與合成氣制備二甲醚比較,該工藝的優點是反應溫度低,轉化率高,其缺點是
.




 閱讀快車系列答案
閱讀快車系列答案