
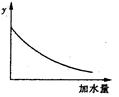
| A.溶液的pH | B.醋酸的電離平衡常數 |
| C.溶液的導電能力 | D.醋酸的電離程度 |
科目:高中化學 來源:不詳 題型:填空題
 H++A2-
H++A2-查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.c(CH3COOH)變為原來的1/10 |
| B.c(H+)變為原來的1/10 |
| C.c(CH3COO-)/c(CH3COOH)的比值增大 |
| D.溶液的導電性增強 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| 弱酸 | HCOOH | HCN | H2CO3 |
| 電離平衡常數(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 、H+、Fe2+、Al3+、Cu2+)可制備高性能磁性材料碳酸錳(MnCO3)。其中一種工業流程如下:
、H+、Fe2+、Al3+、Cu2+)可制備高性能磁性材料碳酸錳(MnCO3)。其中一種工業流程如下:


查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.稀釋后溶液中c(H+)和c(OH-)均減小 |
| B.稀釋后溶液中c(OH-)變為稀釋前的1/10 |
| C.稀釋過程中氨水的電離平衡向左移動 |
D.稀釋過程中溶液中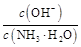 增大 增大 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.HF的電離平衡常數為7.2×10-4 |
| B.HNO2的電離平衡常數為4.9×10-10 |
| C.根據①③兩個反應即可知三種酸的相對強弱 |
| D.HNO2的電離平衡常數比HCN大,比HF小 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.②⑥⑦ | B.③④⑥⑦ | C.③④⑤⑥ | D.①② |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com