
 自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO.
自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO.| 溫度/℃ | 1538 | 1760 | 2404 |
| 平衡常數K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
分析 (1)自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO,說明該反應難以進行,反應的活化能高;
(2)①根據圖表中的平衡常數隨溫度變化趨勢是,溫度越高,K值越大;依據平衡影響因素判斷平衡移動;
②氮氣的轉化率隨溫度升高達到平衡時間短,轉化率高;(3)達到平衡后,要提高N2的轉化率,平衡正向進行,依據化學平衡與原理分析選項;
(4)依據熱化學方程式和蓋斯定律計算得到所需熱化學方程式.
解答 解:(1)閃電或者高溫,主要是提供能量 給N2分子,讓其破壞變成氮原子,因此,只能說明 引發反應所需要的能量高即活化能,不能說明反應吸收的能量高,
故答案為:A;
(2)①在不同溫度下,反應N2(g)+O2(g)?2NO(g)的平衡常數K隨溫度升高K值增大,所以正反應方向是吸熱反應,△H>0,故答案為:>;
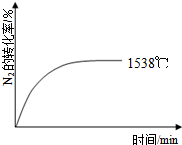
②1760℃、2404℃時N2的轉化率隨時間變化的示意圖,根據溫度越高平衡需要時間越短,氮氣轉化率越大,畫出圖象為: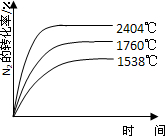 ,
,
故答案為: ;
;
(3)N2(g)+O2(g)?2NO(g),反應是氣體體積不變的吸熱反應,達到平衡后,要提高N2的轉化率,平衡正向進行,依據化學平衡與原理分析選項
A.反應是吸熱反應,降低溫度,平衡正向進行,氮氣轉化率增大,故A符合;
B.加催化劑改變反應速率不改變化學平衡,氮氣轉化率不變,故B不符合;
C.反應前后氣體體積不變,增加壓強,平衡不動,氮氣轉化率不變,故C不符合;
D.增加O2濃度平衡正向進行,氮氣轉化率增大,故D不符合;
E.分離出一氧化氮,平衡正向進行,氮氣轉化率增大,故E符合;
故答案為:AE;
(4)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
與蓋斯定律②×2-①得到肼與NO2反應的熱化學方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
故答案為:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
點評 本題考查了化學耦合影響因素分析和計算,熱化學方程式書寫和蓋斯定律計算應用,咋給我基礎是關鍵,題目較簡單.


 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:多選題
| A. | 飽和碳酸鈉溶液中通入過量二氧化碳氣體:CO32-+CO2+H2O═2HCO3- | |
| B. | NaHCO3溶液中滴入偏鋁酸鈉溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| C. | NaHSO3溶液與FeCl3溶液混合溶液顏色變淺:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向水中加人稀氨水,平衡逆向移動,c(OH-)降低 | |
| B. | 向水中加入少量固體硫酸氫鈉,c(H+)增大,Kw不變 | |
| C. | 向水中加人少量固體NaCl,平衡逆向移動,c(H+)降低 | |
| D. | 將水加熱,Kw增大,pH不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 需要加熱才能發生的反應一定是吸熱反應 | |
| B. | 原電池的電極材料中必須至少有一極是金屬 | |
| C. | 犧牲陽極的陰極保護法是利用了電解原理 | |
| D. | 用電解法精煉銅時,粗銅作陽極,純銅作陰極 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所含有分子數相同 | B. | 所含有氧原子的個數相等 | ||
| C. | 所含有氫原子的個數不相等 | D. | 所含有原子的總數相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化還原反應中一定有氧元素參與 | |
| B. | 氧化還原反應中所有元素化合價都變化 | |
| C. | 氧化還原反應只有一種元素的化合價變化 | |
| D. | 氧化還原反應中電子有得必有失,化合價有升必有降 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{\;}^{12}C$ 與${\;}_{\;}^{14}C$互為同素異形體 | |
| B. | 金剛石與石墨互為同位素 | |
| C. | 二甲醚與乙醇互為同分異構體 | |
| D. | 乙烷與乙烯互為同系物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com