
【題目】阿伏加德羅常數約為 6.02×1023 mol1,下列敘述中正確的是( )
A. 常溫常壓下,18.0 g 重水(D2O)所含的電子數約為 10×6.02×1023 個
B. 一定條件下,46.0 g 二氧化氮和四氧化二氮的混合氣體中含有的氮原子數約為 6.02×1023 個
C. 已知:CO(g) +2H2(g)![]() CH3OH(g) ΔH=-91 kJ·mol-1 ,一定條件下若加入 6.02×1023個CO和2×6.02×1023個H2,則放出91 kJ的熱量
CH3OH(g) ΔH=-91 kJ·mol-1 ,一定條件下若加入 6.02×1023個CO和2×6.02×1023個H2,則放出91 kJ的熱量
D. 1.0 L 1.0mol·L1 CH3COOH溶液中,CH3COOH分子數約為6.02×1023 個
【答案】B
【解析】
A.D2O的摩爾質量為20 g/mol,常溫常壓下,18.0 g 重水(D2O)物質的量小于1mol,所含的電子數小于10×6.02×1023 個,故A錯誤。
B.二氧化氮和四氧化二氮的最簡式都是NO2,可以看作46.0 g的NO2,46.0 g的NO2是1mol,含有6.02×1023 個氮原子,故B正確。
C.一定條件下6.02×1023個CO和2×6.02×1023個H2,也就是1 mol的CO和2 mol的H2,此反應是可逆反應,1 mol的CO和2 mol的H2不可能完全轉化為1 mol CH3OH(g),故放出熱量少于91 kJ,故C錯誤。
D.CH3COOH是弱電解質,1.0 L 1.0mol·L1 CH3COOH溶液中,CH3COOH分子數少于6.02×1023 個,故D錯誤。本題選B。


科目:高中化學 來源: 題型:
【題目】現使用酸堿中和滴定法測定市售白醋的含酸量(g/100 mL)。
Ⅰ、實驗步驟:
(1)量取10.00 mL食用白醋,在燒杯中用水稀釋后轉移到100 mL________(填儀器名稱)中定容,搖勻即得待測白醋溶液。
(2)用酸式滴定管取待測白醋溶液20.00 mL于錐形瓶中,向其中滴加2滴________作指示劑。
(3)讀取盛裝0.1000 mol/L NaOH溶液的堿式滴定管的初始讀數。如果液面位置如下圖所示,則此時的讀數為________mL。
![]()
(4)滴定。當______________時,停止滴定,并記錄NaOH溶液的終讀數。重復滴定3次。
Ⅱ、實驗記錄
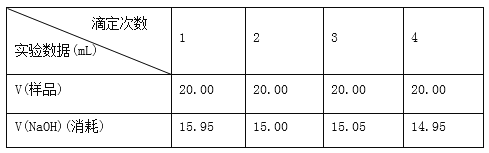
Ⅲ、數據處理與討論:
(1)按正確數據處理,可得市售白醋含酸量=________g/100 mL(結果保留四位有效數字)。
(2)乙同學仔細研究了該品牌白醋的標簽,發(fā)現其中還含有苯甲酸鈉作為食品添加劑,他想用資料法驗證醋酸與苯甲酸鈉不會發(fā)生離子互換反應,需查找在一定溫度下的醋酸與苯甲酸的______(填寫序號)。
a.pH b.沸點 c.電離常數 d.溶解度
(3)在本實驗的滴定過程中,下列操作會使實驗結果偏大的是________(填寫序號)。
a.堿式滴定管在滴定時未用標準NaOH溶液潤洗
b.堿式滴定管的尖嘴在滴定前有氣泡,滴定后氣泡消失
c.錐形瓶中加入待測白醋溶液后,再加少量水
d.錐形瓶在滴定時劇烈搖動,有少量液體濺出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學中常借助曲線圖來表示某種變化過程,有關下列四個曲線圖的說法正確的是

A. 曲線圖①可以表示對某化學平衡體系改變溫度后反應速率隨時間的變化
B. 曲線圖②可以表示向一定量的氫氧化鈉溶液中滴加一定濃度的稀硫酸時pH變化
C. 曲線圖③可以表示相同pH的CH3COOH和HCl溶液分別加水稀釋時溶液的pH隨溶液體積變化的曲線
D. 曲線圖④可以表示所有的固體物質溶解度隨溫度的變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯水中存在多種分子和離子,它們在不同的反應中表現各自的性質。下列實驗現象和結論一致且正確的是( )
A. 加入有色布條,一會兒有色布條退色,說明有Cl2存在
B. 溶液呈黃綠色,且有刺激性氣味,說明有HClO分子存在
C. 先加入硝酸酸化,再加入AgNO3溶液產生白色沉淀,說明有Cl-存在
D. 加入NaOH溶液,氯水黃綠色消失,說明有HClO分子存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A. 標準狀況下,18g水的體積約為 22.4L
B. 25℃,1.01×105Pa,64gSO2中含有的氧原子數為3NA
C. NA個一氧化碳分子和 0.5mol 甲烷的質量比為 7∶4
D. 同溫同壓下,相同體積的氣體單質含有的原子數目不一定相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業(yè)廢水中常含有一定量的Cr2O72-和CrO42-,它們會對生態(tài)系統(tǒng)造成很大的損害,其中還原沉淀法是常用的一種處理方法。流程如下:
![]()
其中第①步中存在平衡:2CrO42- (黃色)+2H+![]() Cr2O72- (橙色)+H2O。下列有關說法正確的是( )
Cr2O72- (橙色)+H2O。下列有關說法正確的是( )
A. 對于上述平衡,加入適量稀硫酸后,溶液顏色變黃色,則有利于CrO42-的生成
B. 第①步當2v(Cr2O72-)=v(CrO42-)時,達到了平衡狀態(tài)
C. 第②步中,還原0.1 mol Cr2O72-需要91.2 g FeSO4
D. 常溫下,Cr(OH)3的溶度積Ksp=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH應調至9
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組進行Fe(OH)3膠體的制備實驗并檢驗其相關性質。
(1)若向裝有飽和FeCl3溶液的燒杯中分別滴入下列物質中,能形成膠體的是_______(填序號)。
a.冷水 b.沸水 c.NaOH濃溶液 d.NaCl濃溶液
(2)寫出制備Fe(OH)3膠體的化學方程式:_____________________
(3)用激光筆照射裝有Fe(OH)3膠體的燒杯,能在側面看到一條_________,這種現象稱為丁達爾效應
(4)Fe(OH)3膠體與Fe(OH)3沉淀的本質區(qū)別是________(填序號)。
a.分散質粒子大小不同 b.顏色不同 c.后者不穩(wěn)定
(5)若向制得的膠體中再加入稀HCl,紅褐色分散系會被破壞,變?yōu)辄S色溶液,寫出相關離子方程式 ____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】周期表中有些元素有“隔類相似”現象(即對角線相似),如Mg與Li;Si和B;Be和Al等,現用熔融LiCl電解可得鋰和氯氣,若用已潮解的LiCl加熱蒸干并強熱至熔融,再用惰性電
極電解。結果得到金屬鋰和一種無色無味氣體,其主要理由是( )
A. 電解出的鋰和水反應放出氫氣
B. 電解前LiCl在加熱時水解
C. 電解時產生的無色氣體是氯氣
D. 在高溫時陽極放出氯氣與水作用釋氧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 己知化合物N是一種對氨基苯甲酸酯類物質,可作局部麻醉藥。合成N的一種路線如下圖:

已知以下信息:
①核磁共振氫譜顯示B只有一種化學環(huán)境的氫,H苯環(huán)上有兩種化學環(huán)境的氫;
②
③E為芳香烴,其相對分子質量為92;
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列問題:
(1)A的化學名稱是_______________,檢驗B中官能團的試劑是____________,N中官能團的名稱是_________________。
(2)由E生成F的化學方程式為____________________________。
(3)由F生成G的反應類型為______________,H在一定條件下可以發(fā)生聚合反應,寫出該聚合反應的化學方程式:_______________________。
(4)D的同分異構體中不能與金屬鈉反應生成氫氣的共有________種(不考慮立體異構)。
(5)參照上述合成路線,以乙烯、干醚和環(huán)氧乙烷為原料(無機試劑任選)制備1,6-已二醛,設計合成路線:_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com