
研究CO2的利用對促進低碳社會的構建具有重要意義。
(1)將CO2與焦炭作用生成CO,CO可用于煉鐵等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g)? △H 1 = +489.0 kJ·mol-1
C(石墨) +CO2(g) = 2CO(g)?? ???????? △H 2 = +172.5 kJ·mol-1
則CO還原Fe2O3(s)的熱化學方程式為???? ????? ?????? 。
(2)二氧化碳合成甲醇是碳減排的新方向,將CO2轉化為甲醇的熱化學方程式
CO2(g) +3H2(g) CH3OH(g) +H2O(g)? △H
CH3OH(g) +H2O(g)? △H
①該反應的平衡常數表達式為K=???? ????? ???????? 。
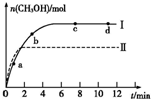
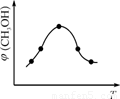
②取一定體積CO2和H2的混合氣體(物質的量之比為1∶3),加入恒容密閉容器中,發生上述反應。反應過程中測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系如圖A所示,則該反應的ΔH ? ??? 0(填“>”、“<”或“=”)。

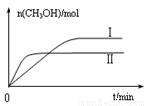
③在兩種不同條件下發生反應,測得CH3OH的物質的量隨時間變化如圖B所示,曲線I、Ⅱ對應的平衡常數大小關系為KⅠ????? KⅡ(填“>” 或“<”)。
(3)以CO2為原料還可以合成多種物質。①工業上尿素[CO(NH2)2]由CO2和NH3在一定條件下合成,其反應方程式為???? ??????????????????????????????? 。當氨碳比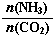 =3,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為 ????????????????? 。
=3,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為 ????????????????? 。
②用硫酸溶液作電解質進行電解,CO2在電極上可轉化為甲烷,該電極反應的方程式為???????????????? 。
(1)Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)? △H? = —28.5 kJ·mol-1(3分)(方程式、狀態正確給1分,△H符號、數據、單位正確給2分)
(2)①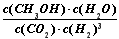 (2分)??? ②<(2分)? ③>(2分)
(2分)??? ②<(2分)? ③>(2分)
(3)①2NH3+CO2 CO(NH2)2+H2O(2分)(配平錯扣1分)?
CO(NH2)2+H2O(2分)(配平錯扣1分)?
40%或0.4(2分)
②CO2+8e—+8H+=CH4+2H2O(3分)(配平錯扣2分)
【解析】
試題分析:(1)根據已知方程式和蓋斯定律,所求方程式可由①-②×3得,△H = △H 1-3△H 2 = +489.0 kJ·mol-1-3×172.5 kJ·mol-1 =—28.5 kJ·mol-1 ,所以CO還原氧化鐵的熱化學方程式為:Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g)? △H? = —28.5 kJ·mol-1 。
(2)①根據給出的熱化學方程式可得出該反應的平衡常數表達式為:K= 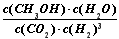 ? ,
? ,
②圖A中生成物甲醇的體積分數隨著溫度升高呈現出先增大后減小的變化,可以分析為達到最高點之前反應并未達到平衡,隨溫度升高反應速率加快,甲醇含量不斷增大;當達到一定值時,反應達到平衡,此時再升高溫度平衡發生移動,甲醇含量下降可以看出平衡逆向移動,所以該反應正反應為放熱反應,ΔH<0。
③圖B中不同條件下反應達到平衡時得到的甲醇的物質的量I>Ⅱ,所以I條件下的反應進行程度更大,所以KⅠ>KⅡ 。
(3)①工業用CO2和NH3在一定條件下合成尿素,該反應方程式可以由C:N比進行配平,所以方程式為: 2NH3+CO2 CO(NH2)2+H2O;根據方程式中的系數可知,反應的n(NH3)=2n(CO2),而總的n(NH3)=3n(CO2),所以假設的CO2有1mol,則有n(NH3)=3n(CO2)=3mol,反應的n(NH3)=2×1×0.6 =1.2mol所以氨氣的平衡轉化率為40%。
CO(NH2)2+H2O;根據方程式中的系數可知,反應的n(NH3)=2n(CO2),而總的n(NH3)=3n(CO2),所以假設的CO2有1mol,則有n(NH3)=3n(CO2)=3mol,反應的n(NH3)=2×1×0.6 =1.2mol所以氨氣的平衡轉化率為40%。
②在酸性電介質中發生電解反應,考慮氫離子參加反應,CO2在電極上得電子被還原為甲烷,有水生成,所以電極反應式為:CO2+8e—+8H+=CH4+2H2O。
考點:本題考查的是化學反應原理的知識,主要涉及熱化學方程式的書寫、蓋斯定律的應用、平衡常數的表達、焓變的大小判斷、平衡圖像的理解等知識。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| 容 器 | 甲 | 乙 |
| 反應物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 研究CO2的利用對促進低碳社會的構建具有重要的意義.
研究CO2的利用對促進低碳社會的構建具有重要的意義.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:
 研究CO2的利用對促進低碳社會的構建具有重要的意義.
研究CO2的利用對促進低碳社會的構建具有重要的意義.查看答案和解析>>
科目:高中化學 來源:2014屆江蘇省宿遷市高三上學期第一次摸底考試化學試卷(解析版) 題型:填空題
研究CO2的利用對促進低碳社會的構建具有重要意義。
(1)將CO2與焦炭作用生成CO,CO可用于煉鐵等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H 1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) △H 2=+172.5 kJ·mol-1
則CO還原Fe2O3(s)的熱化學方程式為 。
(2)二氧化碳合成甲醇是碳減排的新方向,將CO2轉化為甲醇的熱化學方程式為:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H
CH3OH(g)+H2O(g)
△H
①該反應的平衡常數表達式為K= 。
②取一定體積CO2和H2的混合氣體(物質的量之比為1∶3),加入恒容密閉容器中,發生上述反應。反應過程中測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系如圖所示,則該反應的ΔH 0(填“>”、“<”或“=”)。
③在兩種不同條件下發生反應,測得CH3OH的物質的量隨時間變化如圖所示,曲線I、Ⅱ對應的平衡常數大小關系為KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2為原料還可以合成多種物質。
①工業上尿素[CO(NH2)2]由CO2和NH3在一定條件下合成,其反應方程式為 。當氨碳比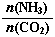 =3,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為
=3,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為
。
②用硫酸溶液作電解質進行電解,CO2在電極上可轉化為甲烷,該電極反應的方程式為 。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年江蘇省蘇南四校高三12月月考試化學試卷(解析版) 題型:填空題
(14分)研究CO2的利用對促進低碳社會的構建具有重要的意義。
(1)已知石墨的標準燃燒熱為y kJ·mol-1,1.2g石墨在1.68L(標準狀況)氧氣中燃燒,至反應物耗盡,放出x kJ熱量。則石墨與氧氣反應生成CO的熱化學方程式為 ,
(2)高溫時,用CO還原MgSO4可制備高純MgO。
①750℃時,測得氣體中含等物質的量SO2和SO3,此時反應的化學方程式是 。
②由MgO可制成“鎂—次氯酸鹽”燃料電池,其裝置示意圖如圖1,該電池反應的離子方程式為 。



圖1 圖2 圖3
(3)二氧化碳合成甲醇是碳減排的新方向,將CO2轉化為甲醇的熱化學方程式為:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①該反應的平衡常數表達式為K= 。
②取五份等體積CO2和H2的混合氣體(物質的量之比均為1∶3),分別加入溫度不同、容積相同的恒容密閉容器中,發生上述反應,反應相同時間后,測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系曲線如圖2所示,則上述CO2轉化為甲醇反應的ΔH (填“>” “<”或“=”)0。
③在兩種不同條件下發生反應,測得CH3OH的物質的量隨時間變化如圖3所示,曲線I、Ⅱ對應的平衡常數大小關系為KⅠ KⅡ(填“>” “<”或“=”)。
④一定溫度下,在容積相同且固定的兩個密閉容器中,按如下方式投入反應物,一段時間后達到平衡。
|
容 器 |
甲 |
乙 |
|
反應物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后氣體的壓強為開始時的0.8倍,要使平衡后乙與甲中相同組分的體積分數相等,且起始時維持反應逆向進行,則c的取值范圍為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com