
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中,高氯酸的酸性最強 | |
| B. | 水對于這四種酸的強弱沒有區分能力,但醋酸可以區分這四種酸的強弱 | |
| C. | 在冰醋酸中1mol/L的高氯酸的電離度約為0.4% | |
| D. | 在冰醋酸中硫酸的電離方程式為:H2SO4═2H++SO42- |
分析 A.在冰醋酸中,酸的電離平衡常數越大,則其電離程度越大,酸性越強;
B.在溶劑中完全電離的電解質不能區分,不完全電離的電解質能區分;
C.先根據電離平衡常數計算氫離子濃度,氫離子濃度等于電離的高氯酸濃度,再根據電離度公式計算電離度;
D.不完全電離的酸存在電離平衡,電離方程式應用可逆號.
解答 解:A.在醋酸中,四種酸中高氯酸的電離平衡常數最大,所以高氯酸的酸性最強,故A正確;
B.這四種酸在水中都完全電離,在冰醋酸中電離程度不同,所以水對于這四種酸的強弱沒有區分能力,但醋酸可以區分這四種酸的強弱,故B正確;
C.在冰醋酸中高氯酸電離出的c(H+)=$\sqrt{1.6×1{0}^{-5}×1}$mol/L=4×10-3mol/L,氫離子濃度等于電離的高氯酸濃度,所以高氯酸的電離程度=$\frac{4×1{0}^{-3}mol/L}{1mol/L}$×100%=0.4%,故C正確;
D.在冰醋酸中,硫酸不完全電離,所以硫酸的電離方程式中應該用可逆號,且分步電離,主要以第一步為主,正確的電離方程式為:H2SO4?H++HSO4-,故D錯誤;
故選D.
點評 本題考查了電解質的電離,題目難度中等,明確電離平衡常數與酸的強弱之間的關系,根據酸在水溶液里或冰醋酸中電離程度確定電解質強弱與溶劑的關系,注意該溶液的溶劑是冰醋酸不是水.


科目:高中化學 來源: 題型:填空題
 E、G、M、Q、T是五種原子序數依次增大的前四周期元素.E、G、M是位于P區的同一周期的元素,M的價層電子排布為nsnnp2n,E與M原子核外的未成對電子數相等;QM2與GM2-為等電子體;T為過渡元素,其原子核外沒有未成對電子.請回答下列問題:
E、G、M、Q、T是五種原子序數依次增大的前四周期元素.E、G、M是位于P區的同一周期的元素,M的價層電子排布為nsnnp2n,E與M原子核外的未成對電子數相等;QM2與GM2-為等電子體;T為過渡元素,其原子核外沒有未成對電子.請回答下列問題: .E、M電負性相差1.0,由此可以判斷EM應該為極性較強的分子,但實際上EM分子的極性極弱,請解釋其原因從電負性分析,CO中的共用電子對偏向氧原子,但分子中形成配位鍵的電子對是由氧原子單方面提供的,抵消了共用電子對偏向O而產生的極性.
.E、M電負性相差1.0,由此可以判斷EM應該為極性較強的分子,但實際上EM分子的極性極弱,請解釋其原因從電負性分析,CO中的共用電子對偏向氧原子,但分子中形成配位鍵的電子對是由氧原子單方面提供的,抵消了共用電子對偏向O而產生的極性.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化鋁陶瓷和光導纖維都是無機非金屬材料 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物質 | |
| C. | 使用氫能源替代化石燃料可減少CO2排放 | |
| D. | 利用太陽能在催化劑參與下分解水制氫是把光能轉化為化學能的綠色化學方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
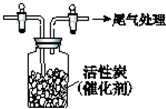 某學習小組依據SO2具有還原性,推測SO2能被Cl2氧化生成SO2Cl2.查閱資料:SO2Cl2常溫下為無色液體,極易水解,遇潮濕空氣會產生白霧.
某學習小組依據SO2具有還原性,推測SO2能被Cl2氧化生成SO2Cl2.查閱資料:SO2Cl2常溫下為無色液體,極易水解,遇潮濕空氣會產生白霧.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl→H2SO4→H2S→NaOH→CO2 | B. | NaCl→Na2SO4→NaOH→H2S→CO2 | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→CO2 | D. | Na2SO4→HCl→H2S→NaOH→CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com