
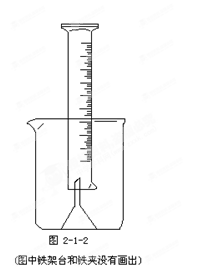


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源:不詳 題型:單選題
| A.濃硫酸稀釋后,沒有冷卻直接轉移到容量瓶中 | B.定容時俯視刻度線 |
| C.轉移過程中沒有洗滌小燒杯 | D.容量瓶洗凈后,沒有干燥 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
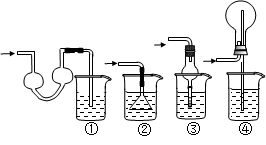
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.用1mol的醋酸溶液和1.01mol的氫氧化鈉溶液做中和熱實驗測得中和熱的數值為57.3KJ/mol |
| B.通過實驗得知在常溫常壓下,12g固體C和32g氣體O2所具有的總能量一定大于44g氣體CO2所具有的總能量 |
| C.室溫下,用廣泛pH試紙測得某溶液的pH為2.3 |
| D.用25mL滴定管做中和滴定時,用去某濃度的堿溶液21.7mL |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| 編號 | 實驗內容 | 實驗目的 |
| A | 在Na2SO3溶液中加入HNO3酸化的Ba(NO3)2 ,產生白色沉淀 | 檢驗Na2SO3是否變質 |
| B | 將某氣體通入品紅溶液中,品紅褪色 | 證明該氣體是SO2 |
| C | 用潔凈的玻璃棒蘸取NaOH溶液,點在濕潤的pH試紙上,與標準比色卡對照 | 測定NaOH溶液的pH |
| D | 在兩支試管中各加入4 mL 0.01 mol/L的KMnO4 酸性溶液,再分別加入0.1 mol/L H2C2O4 溶液2 mL、0.2 mol/L H2C2O4 溶液2 mL, 分別記錄溶液褪色所需時間 | 探究相同條件下,溶液濃度對反應速率的影響 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
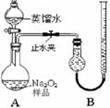
| 實驗次數 | 第一次 | 第二次 | 第三次 | 第四次 |
| 標準鹽酸體積(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
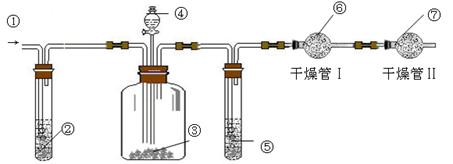
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
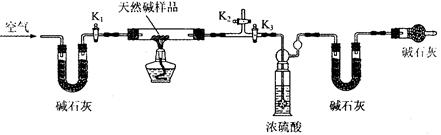
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
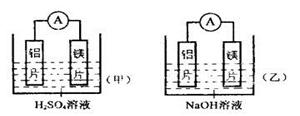
| A.利用原電池反應判斷金屬活動性順序時應注意選擇合適的電解質 |
| B.鎂的金屬性不一定比鋁的金屬性強 |
| C.該實驗說明金屬活動順序表已過時,已設有實用價值 |
| D.該實驗說明化學研究對象復雜、化學反應受條件影響較大,因此應具體問題具體分析 |
 xC(g) + D(g),反應達到平衡時C的濃度為1.2 mol/L,B的濃度為0.1 mol/L。
xC(g) + D(g),反應達到平衡時C的濃度為1.2 mol/L,B的濃度為0.1 mol/L。查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com