
【題目】Ι.用50mL 0.50mol/L鹽酸跟50mL 0.55mol/L NaOH溶液中和反應過程中所放出的熱量計算中和熱 。
(1)燒杯間填滿泡沫塑料的作用是___________________________________;
(2)大燒杯上若不蓋硬紙板,求得的中和熱數值______(填“偏大”、“偏小”、“無影響”)
(3)如圖所示,儀器A的名稱是____________________;

(4)重復三次實驗,記錄的實驗數據如下:
實驗用品 | 溶液溫度 | |||
t1 | t2 | |||
① | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ |
② | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 25.5 ℃ |
③ | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ |
已知:Q=cmΔt,反應后溶液的比熱容c為4.18 kJ·℃-1·kg-1,各物質的密度均為1 g·cm-3。計算ΔH=___________kJ/mol
(5)實驗中改用80mL 0.50mol/L鹽酸跟100mL 0.55mol/L NaOH溶液進行反應,與上述實驗相比,所放出的熱量______(填“相等、“不相等”),所求中和熱______(填“相等、“不相等”).
Ⅱ.某研究性學習小組設計了一組實驗來探究元素周期律。甲同學一次性完成N、C、Si的非金屬性強弱的比較;乙同學完成了氧元素的非金屬性比硫強的實驗。

(1)從以下所給物質中選出甲同學設計的實驗所用到物質:
①稀HNO3溶液②稀鹽酸③碳酸鈣④Na2SiO3 溶液⑤SiO2
試劑A為_________;試劑C為_________(填序號)
(2)乙同學設計的實驗所用到試劑A為________;裝置C中反應的化學方程式為___________________________。
【答案】 保溫、隔熱、減少熱損失 偏小 環形玻璃攪拌棒 -56.8 不相等 相等 ① ④ H2O2 O2+2H2S=2S↓+2H2O
【解析】分析:Ι.(1)根據實驗中盡可能減少熱量損失分析;
(2)不蓋硬紙板,會有一部分熱量散失;
(3)根據儀器構造分析;
(4)先根據表中測定數據計算出混合液反應前后的平均溫度差,再根據Q=cm△T計算出反應放出的熱量,然后計算出生成1mol水放出的熱量,就可以得到中和熱;
(5)反應放出的熱量和所用酸以及堿的量的多少有關,并根據中和熱的概念和實質來回答;
Ⅱ.(1)依據裝置中為強酸制備弱酸依此選擇試劑;
(2)通過比較單質的氧化性來判斷非金屬性,氧氣與硫化氫反應生成硫沉淀。
詳解:Ι.(1)中和熱的測定實驗中要盡可能減少熱量損失,則燒杯間填滿泡沫塑料的作用是保溫、隔熱、減少熱損失;
(2)大燒杯上如不蓋硬紙板,會使一部分熱量散失,所以測得的中和熱數值偏小;
(3)根據儀器構造可判斷儀器A的名稱是環形玻璃攪拌棒;
(4)第1次實驗鹽酸和NaOH溶液起始平均溫度為20℃,反應后溫度為23.3℃,反應前后溫度差為3.3℃;第2次實驗鹽酸和NaOH溶液起始平均溫度為20℃,反應后溫度為25.5℃,反應前后溫度差為:5.5℃;第3次實驗鹽酸和NaOH溶液起始平均溫度為20℃,反應后溫度為23.5℃,反應前后溫度差為:3.5℃;第2組數據相差較大,舍去,2次試驗的平均值為3.4℃;取50mL 0.50mol/L鹽酸跟50mL 0.55mol/L NaOH溶液進行實驗,生成水的物質的量為0.05L×0.50mol/L=0.025mol,溶液的質量為100mL×1g/mL=80g,溫度變化的值為△T=3.4℃,則生成0.025mol水放出的熱量為Q=mc△T=100g×4.18J/(g℃)×3.4℃=1421.2J,即1.4212kJ,所以實驗測得的中和熱△H=-(1.4212kJ/0.025mol)=-56.8kJ/mol;
(5)反應放出的熱量和所用酸以及堿的量的多少有關,實驗中改用80mL 0.50mol/L鹽酸跟100mL 0.55mol/L NaOH溶液進行反應,與上述實驗相比,生成水的量增多,所放出的熱量偏高,但是中和熱是強酸和強堿反應生成1mol水時放出的熱,與酸堿的用量無關,所以改用實驗中改用80mL 0.50mol/L鹽酸跟100mL 0.55mol/L NaOH溶液進行上述實驗,測得中和熱數值相等;
Ⅱ.(1)通過比較酸性強弱來判斷非金屬性強弱,裝置中為強酸制備弱酸,所以A中試劑為稀硝酸,B中為碳酸鈣,C中為Na2SiO3溶液;
(2)要完成O元素的非金屬性比S強的實驗研究,通過比較單質的氧化性來判斷非金屬性,所以用二氧化錳作催化劑使雙氧水分解生成氧氣,即A中試劑是雙氧水。氧氣通過氫硫酸或硫化鈉溶液會生成硫單質,其反應的方程式為:2H2S+O2=2S↓+2H2O。


科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,針對表中的①~⑩中10種元素回答以下問題:

Ⅰ.填寫下列空白:
(1)寫出⑧元素在周期表的位置______________________;
(2)實驗室制取②氫化物的化學方程式_______________________________________;
②的氫化物與其最高價氧化物水化物反應生成的物質是________________(填名稱)
(3)⑦的氯化物物理性質非常特殊,如熔點為190℃,但在180℃就開始升華。據此判斷該氯化物是________(填“共價化合物”或“離子化合物”),可以證明你判斷正確的實驗依據為:_____________________________________________________________________。
(4)用電子式表示④、⑥兩元素結合成化合物的形成過程____________________________。
Ⅱ.由上述部分元素組成的物質間,在一定條件下,可以發生下圖中的變化,其中A是一種淡黃色固體,可作供氧劑;X是一種氫化物,常溫下為液體,則:
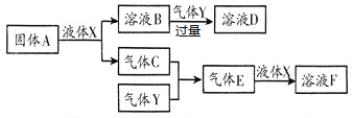
(1)A的電子式為_________________;
(2)氣體Y是一種大氣污染物,無色有刺激性氣味,直接排放會形成酸雨。寫出溶液D與酸性高錳酸鉀溶液反應的離子方程式:_________________________________________;
(3)在含2molF的濃溶液中加入1mol鋅片加熱使之充分反應,產生氣體的體積為_____ L(標準狀況下)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同質量的SO2和SO3它們之間的關系是
A. 所含硫原子的物質的量之比為1:1
B. 氧原子的物質的量之比為3:2
C. 氧元素的質量比為5:6
D. 硫元素的質量比為4:5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上利用無機礦物資源生產部分材料的流程示意圖如下。下列說法正確的是( )
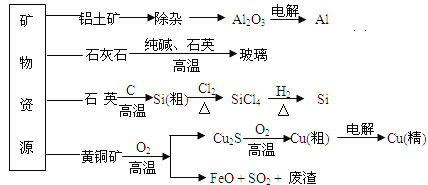
(注:鋁土礦中含有A12O3、SiO2、Fe2O3)
A. 在鋁土礦制備較高純度A1的過程中只用到NaOH溶液、CO2氣體、冰晶石
B. 石灰石、純堿、石英、玻璃都屬于鹽,都能與鹽酸反應
C. 在制粗硅時,氧化劑與還原劑的物質的量之比為1∶2
D. 黃銅礦(CuFeS2)與O2反應產生的Cu2S、SO2均是還原產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A. 原子最外層只有1個電子的元素一定是金屬元素
B. 最外層電子數比次外層電子數多的元素一定位于第二周期
C. 氯元素的近似相對原子質量為35.5,則它在自然界中存在的兩種同位素35Cl和37Cl的原子個數比為1:3
D. 金屬與非金屬分界線附近的元素既有金屬性,又有非金屬性,稱為過渡元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣及其相關產品是基本化工原料,在化工領域中具有重要的作用.
(1)以鐵為催化劑,0.6mol氮氣和1.8mol氫氣在恒溫、容積恒定為1L的密閉容器中反應生成氨氣,20min后達到平衡,氮氣的物質的量為0.3mol.
該反應體系未達到平衡時,增大壓強對逆反應速率的影響是(填增大、減少或不變).
(2)①N2H4是一種高能燃料,有強還原性,可通過NH3和NaClO反應制得,寫出該制備反應的化學方程式
②N2H4的水溶液呈弱堿性,室溫下其電離常數K1=1.0×10﹣6 , 則0.01molL﹣1 N2H4水溶液的pH等于
(忽略N2H4的二級電離和H2O的電離).
③已知298K和101KPa條件下,32.0gN2H4在氧氣中完全燃燒生成氮氣和水,放出熱量624kJ,則N2H4(l)的標準燃燒熱的熱化學方程式
(3)科學家改進了NO2轉化為HNO3的工藝(如虛框所示),在較高的操作壓力下,提高N2O4/H2O的質量比和O2的用量,能制備出高濃度的硝酸. ![]()
實際操作中,增大N2O4 , 對此請給出合理解釋
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為確定碳酸鈉和碳酸氫鈉混合樣品中碳酸氫鈉的質量分數,可通過加熱分解得到的CO2質量進行計算,某同學設計的實驗裝置示意圖如圖: 
請回答:
(1)儀器a的作用是 .
(2)裝置B中冰水的作用是 .
(3)該同學設計的實驗裝置存在缺陷,有關該實驗裝置及實驗過程中,下列因素可能使碳酸氫鈉的質量分數偏低的是 .
A.樣品分解不完全
B.裝置
C.C之間缺少CO2的干燥裝置
D.產生CO2氣體的速率太快,沒有被堿石灰完全吸收
E.反應完全后停止加熱,通入過量的空氣.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】東晉《華陽國志南中志》卷四中已有關于白銅的記載,云南鎳白銅(銅鎳合金)聞名中外,曾主要用于造幣,亦可用于制作仿銀飾品.回答下列問題:
(1)鎳元素基態原子的電子排布式為 , 3d能級上的未成對電子數為 .
(2)硫酸鎳溶于氨水形成[Ni(NH3)6]SO4藍色溶液.
①[Ni(NH3)6]SO4中陰離子的立體構型是 .
②在[Ni(NH3)6]SO4中Ni2+與NH3之間形成的化學鍵稱為 , 提供孤電子對的成鍵原子是 .
③氨的沸點(填“高于”或“低于”)膦(PH3),原因是;氨是分子(填“極性”或“非極性”),中心原子的軌道雜化類型為 .
(3)單質銅及鎳都是由鍵形成的晶體;元素銅與鎳的第二電離能分別為:ICu=1958kJmol﹣1、INi=1753kJmol﹣1 , ICu>INi的原因是 .
(4)某鎳白銅合金的立方晶胞結構如圖所示.
①晶胞中銅原子與鎳原子的數量比為 .
②若合金的密度為d gcm﹣3 , 晶胞參數a=nm.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com