銅單質及其化合物在很多領域有重要的用途,如金屬銅用來制造電線電纜,超細銅粉可應用于導電材料、催化劑等領域中;CuCl和CuCl
2都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等.
(1)超細銅粉的某制備方法如下:
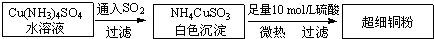
①[Cu(NH
3)
4]SO
4中所含的化學鍵有
.
②向盛有硫酸銅水溶液的試管里加入氨水,首先形成難溶物,繼續(xù)添加氨水,難溶物溶解得到深藍色的透明溶液.下列說法正確的是
(填字母序號).
A.反應后溶液中不存在任何沉淀,所以反應前后Cu
2+的濃度不變
B.沉淀溶解后,將生成深藍色的[Cu(NH
3)
4]
2+配離子
C.向反應后的溶液中加入乙醇,因為[Cu(NH
3)
4]
2+不與乙醇反應,故溶液不會發(fā)生變化
D.在[Cu(NH
3)
4]
2+中,NH
3分子中的氮原子給出孤電子對,Cu
2+有空軌道接受電子對
(2)氯化亞銅(CuCl)的制備過程是:向CuCl
2溶液中通入一定量SO
2,微熱,反應一段時間后即生成CuCl白色沉淀.反應的離子方程式為
.
(3)銅單質晶體中原子的堆積方式如圖甲所示,其晶胞特征如下圖乙所示,原子之間相互位置關系的平面圖如圖丙所示.
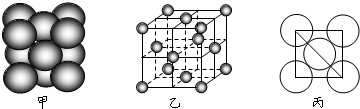
若已知銅的原子半徑為d,N
A代表阿伏加德羅常數,銅的相對原子質量為M,請回答:
①晶胞中銅原子的配位數為
,一個晶胞中銅原子的數目為
;銅單質晶體中原子的堆積方式是
堆積.
②該晶體的密度為
(用字母表示).





 的酸性廢水,可利用微生物電池法除去,其原理如圖2所示
的酸性廢水,可利用微生物電池法除去,其原理如圖2所示
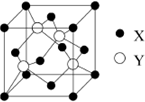 元素X 位于第四周期,其基態(tài)原子的內層軌道全部排滿電子,且最外層電子數為2.元素Y基態(tài)原子的3p 軌道上有4個電子.元素Z 的原子最外層電子數是其內層的3倍.
元素X 位于第四周期,其基態(tài)原子的內層軌道全部排滿電子,且最外層電子數為2.元素Y基態(tài)原子的3p 軌道上有4個電子.元素Z 的原子最外層電子數是其內層的3倍.
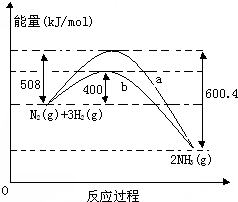 如圖表示常溫常壓下N2(g)與H2(g)反應生成NH3(g)過程中的能量變化曲線,a和b表示不同條件下反應過程中的能量變化曲線.
如圖表示常溫常壓下N2(g)與H2(g)反應生成NH3(g)過程中的能量變化曲線,a和b表示不同條件下反應過程中的能量變化曲線.