
R、X、Y、M、Z五種短周期主族元素的原子半徑依次減小,X、Y、Z的電子層數之和為5,X元素原子的最外層電子數是它的電子層數的2倍,Y元素原子的最外層電子數是X和Z兩元素原子最外層電子數的總和,M是地殼中含量最多的元素,R與Z的最外層電子數相同。下列敘述正確的是( )
A.Z與M形成的化合物中不可能含有非極性鍵
B.對應氫化物的熱穩定性:X>Y>M
C.單質的還原性:R>M>Y>X
D.X、Y、M、Z四種元素組成的離子化合物受熱易分解
D
【解析】由于M是地殼中含量最多的元素,可確定M為O。又據“R、X、Y、M、Z的原子半徑依次減小”且X、Y、Z的電子層數之和為5可知,Z為H,X、Y在第2周期,結合X最外層電子數是它電子層數的2倍可知,X為C,Y為N;又因R與Z的最外層電子數相同且是短周期元素,則R為Li或Na。Z(H)與M(O)形成的化合物有H2O和H2O2,后者含有非極性鍵,A項錯誤;非金屬性:C<N<O,則氣態氫化物的穩定性:H2O>NH3>CH4,B項錯誤;R、M、Y、X對應的單質分別為Li(Na)、O2、N2、C,顯然C項錯誤;H、C、O、N組成的化合物為NH4HCO3或(NH4)2CO3,是離子化合物,受熱易分解,D項正確。


 小學生10分鐘口算測試100分系列答案
小學生10分鐘口算測試100分系列答案科目:高中化學 來源:2014高考化學名師選擇題專練 離子反應練習卷(解析版) 題型:選擇題
常溫時,下列各組離子在指定溶液中一定能大量共存的是( )
A.pH=0的溶液中:Na+、Fe2+、N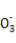 、ClO-
、ClO-
B.c(Fe3+)=0.1 mol/L的溶液中:K+、Ba2+、S 、SCN-
、SCN-
C.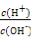 =1012的溶液中:N
=1012的溶液中:N 、Al3+、S
、Al3+、S 、Cl-
、Cl-
D.由水電離的c(H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HS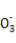
查看答案和解析>>
科目:高中化學 來源:2014高考化學名師選擇題專練 化學反應中的能量變化練習卷(解析版) 題型:選擇題
用惰性電極電解一定量的硫酸銅溶液,實驗裝置如下圖甲。電解過程中的實驗數據如下圖乙,橫坐標表示電解過程中轉移電子的物質的量,縱坐標表示電解過程中產生氣體的總體積(標準狀況)。則下列說法不正確的是( )
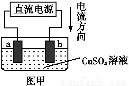
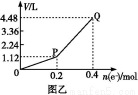
A.電解過程中,a電極表面先有紅色物質析出,后有氣泡產生
B.b電極上發生的反應方程式為:4OH--4e-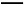 2H2O+O2↑
2H2O+O2↑
C.曲線0~P段表示O2的體積變化
D.從開始到Q點時收集到的混合氣體的平均摩爾質量為12 g/mol
查看答案和解析>>
科目:高中化學 來源:2014高考化學名師選擇題專練 化學與STSE練習卷(解析版) 題型:選擇題
化學與社會、科學、技術、環境密切相關。下列說法不正確的是( )
A.預防H7N9流感病毒的措施之一是高溫消毒餐具等生活日用品
B.《添加劑標準》中兒童膨化食品擬禁含鋁添加劑,鋁對人體有毒害
C.我國京津冀等城市實施SO2、CO2、NO2、N2等大氣污染物排放限值
D.明礬、硫酸鐵等在水中因水解生成膠體粒子,都可用作凈水劑
查看答案和解析>>
科目:高中化學 來源:2014高考化學名師選擇題專練 化學與STSE練習卷(解析版) 題型:選擇題
化學與科學、技術、社會、環境密切相關。下列有關說法中錯誤的是( )
A.推廣使用風能、太陽能等新能源能夠減少溫室氣體的排放
B.餐桌上的瓷盤是硅酸鹽制品
C.制作航天服的聚酯纖維和用于光纜通信的光導纖維都是新型無機非金屬材料
D.用“84”消毒液來殺死H1N1流感病毒是因為病毒蛋白質變性
查看答案和解析>>
科目:高中化學 來源:2014高考化學名師選擇題專練 元素周期表元素周期律練習卷(解析版) 題型:選擇題
依據元素周期表及元素周期律,下列推斷正確的是( )
A.同周期主族元素的原子形成的簡單離子電子層結構相同
B.C比Si的原子半徑小,CH4的穩定性比SiH4弱
C.Na、Mg、Al失電子能力和其最高價氧化物對應的水化物的堿性均依次減弱
D.在元素周期表金屬與非金屬的分界處可以尋找催化劑和耐高溫、耐腐蝕的合金材料
查看答案和解析>>
科目:高中化學 來源:2014高考化學名師選擇題專練 NA的應用練習卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的數值,若等質量的H2O和D2O分別與一定質量的金屬鉀完全反應,轉移的電子數均為 NA,則下列各量不相等的是( )
NA,則下列各量不相等的是( )
A.消耗H2O和D2O的物質的量
B.同溫同壓下生成氣體的體積
C.反應后所得溶液中溶質的質量分數
D.參加反應的鉀的質量
查看答案和解析>>
科目:高中化學 來源:2014高考化學名師綜合題專練 物質性質綜合應用練習卷(解析版) 題型:填空題
鋁廣泛應用于化學工業和日常生活中。工業上由鋁土礦(Al2O3·3H2O的含量約為85%,其余主要為SiO2、Fe2O3等)冶煉金屬鋁的流程如下。
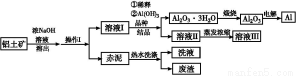
已知拜耳法生產Al2O3·3H2O的基本原理為:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示為2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示為2 Al(OH)3]
(1)操作Ⅰ的名稱為 ,赤泥中除含有鋁硅酸鹽外,還含有的主要物質有 。
(2)為了提高鋁土礦的溶出速率可采取的有效措施為 (任寫三點)。
(3)用化學平衡理論解釋稀釋溶液Ⅰ有利于Al2O3·3H2O 結晶的原因 。
(4)為了析出Al2O3·3H2O,也可向溶液Ⅰ中通入過量CO2氣體,寫出生成Al2O3·3H2O的離子方程式: 。
(5)為了回收赤泥附著液帶走的有用成分,工業上將用熱水洗滌后的洗液用作溶液Ⅰ的稀釋劑,請指出流程圖中另一處類似的做法 。
查看答案和解析>>
科目:高中化學 來源:2014高考化學名師知識點精編 選修2化學與技術練習卷(解析版) 題型:填空題
我國化學家侯德榜改革國外的純堿生產工藝,生產流程可簡要表示如圖
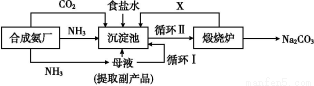
(1)上述生產純堿的方法稱 ,副產品的一種用途為 。
(2)沉淀池中發生的化學反應方程式是 。
(3)寫出上述流程中X物質的分子式 。
(4)使原料氯化鈉的利用率從70%提高到90%以上,主要是設計了 (填上述流程中的編號)的循環。從沉淀池中取出沉淀的操作是 。
(5)為檢驗產品碳酸鈉中是否含有氯化鈉,可取少量試樣溶于水后,再滴加 。
(6)向母液中通氨氣,加入細小食鹽顆粒,冷卻析出副產品,通氨氣的作用有 。
a.增大NH4+的濃度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3轉化為Na2CO3,提高析出的NH4Cl純度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com