
(10分)已知粗銅中含有少量的鋅、鐵、銀、金等金屬和少量礦物雜質(與酸不不反應)。某化學興趣小組在實驗室條件下用以硫酸銅溶液為電解液,用電解的方法實現了粗銅的提純,并對陽極泥和電解液中金屬進行回收和含量測定。
步驟一:電解精制:
請回答以下問題:
電解時,粗銅應與電源的 極相連。陰極上的電極反應式為
電解過程中,硫酸銅的濃度會 (選填:變大、不變、變小)
步驟二:電解完成后,該小組同學按以下流程對電解液進行處理:
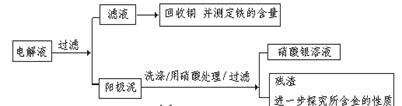
(1)陽極泥的綜合利用:
稀硝酸處理陽極泥得到硝酸銀稀溶液,請你寫出該步反應的離子方程式:
殘渣含有極少量的黃金,如何回收金,他們查閱了有關資料,了解到了一些有關金的知識,以下是他們獲取的一些信息:
|
序號 |
反應 |
平衡常數 |
|
1 |
Au + 6HNO3(濃) |
<< 1 |
|
2 |
Au3+ + 4Cl— |
>>1 |
從中可知,金很難與硝酸反應,但卻可溶于王水(濃硝酸與鹽酸按體積比1∶3的混合物),請你簡要解釋金能夠溶于王水的原因:
(2)濾液含量的測定:以下是該小組探究濾液的一個實驗流程:

則100mL濾液中Cu2+ 的濃度為 mol·L-1 ,Fe2+的濃度為 mol·L-1
步驟一:正;Cu2++2e = Cu;變小
步驟二:(1)3Ag + 4H+ + NO3— = 3Ag+ + NO↑+ 2H2O;濃鹽酸含有大量氯離子,Au3+ 離子與氯離子形成穩定的AuCl4—離子,使反應1平衡向右移動,則金溶于王水中。
(2)0.5;0.1
【解析】
試題分析:第一步:精煉銅時,粗放放在電解池的陽極,與電源正極相連,電極反應為:Cu2++2e = Cu。由于粗銅有比銅活潑的雜質金屬,所以硫酸銅溶液的濃度會變小。
第二步:(1)硝酸和銀反應的離子方程式為:3Ag + 4H+ + NO3— = 3Ag+ + NO↑+ 2H2O。王水能溶解金的原因是濃鹽酸含有大量氯離子,Au3+ 離子與氯離子形成穩定的AuCl4—離子,使反應1平衡向右移動,則金溶于王水中。
(2)根據流程圖可知得到Cu 3.2g所以Cu2+ 的濃度為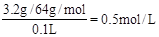 ,得到Fe2O3 4.8g,因此Fe的物質的量為0.06mol,其中有0.05molFe是置換銅時加入的,所以Fe2+的濃度為
,得到Fe2O3 4.8g,因此Fe的物質的量為0.06mol,其中有0.05molFe是置換銅時加入的,所以Fe2+的濃度為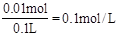 。
。
考點:金屬的冶煉
點評:本題綜合性強,主要考查學生分析問題解決問題的能力。


科目:高中化學 來源: 題型:閱讀理解

| 序號 | 反應 | 平衡常數 |
| ① | Au+6HNO3(濃)?Au(NO3)3+3NO2+3H2O | <<1 |
| ② | Au3++4Cl-?AuCl4- | >>1 |

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 序號 | 反應 | 平衡常數 |
| 1 | Au+6HNO3(濃)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | >>1 |

查看答案和解析>>
科目:高中化學 來源:北京市門頭溝區2010年高三一模(理科綜合)化學部分 題型:實驗題
(14分)已知粗銅中含有少量的鋅、鐵、銀、金等金屬和少量礦物雜質(雜質與酸不反應)。某化學興趣小組在實驗室條件下以硫酸銅溶液為電解液,用電解的方法實現了粗銅的提純,并對陽極泥和電解液中金屬進行回收和含量測定。
步驟一:電解精制:
電解時,粗銅應與電源的 ▲ _極相連,陰極上的電極反應式為 ▲ 。
電解過程中,硫酸銅的濃度會 ▲ (選填:變大、不變、變小)。
步驟二:電解完成后,該小組同學按以下流程對電解液進行處理:
(1)陽極泥的綜合利用:
稀硝酸處理陽極泥得到硝酸銀稀溶液,請你寫出該步反應的離子方程式: ▲ 。殘渣含有極少量的黃金。為了回收金,他們查閱了有關資料(見下表):
| 序號 | 反應 | 化學平衡常數 |
| 1 | Au + 6HNO3(濃) Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl- =" " AuCl4- | >>1 |

查看答案和解析>>
科目:高中化學 來源:2013-2014學年江西省高三第四次模考化學試卷(解析版) 題型:填空題
(8分)已知粗銅中含有少量的鋅、鐵、銀、金等金屬和少量礦物雜質(與酸不反應)。某化學興趣小組在實驗室條件下用以硫酸銅溶液為電解液,用電解的方法實現了粗銅的提純,并對陽極泥和電解液中金屬進行回收和含量測定。步驟一:電解精制:
請回答以下問題:電解時,陰極上的電極反應式為 ;
步驟二:電解完成后,該小組同學按以下流程對電解液進行處理:

(1)陽極泥的綜合利用:
稀硝酸處理陽極泥得到硝酸銀稀溶液,請你寫出該步反應的離子方程式: 。
殘渣含有極少量的黃金,如何回收金,他們查閱了有關資料,了解到了一些有關金的知識,以下是他們獲取的一些信息:
|
序號 |
反應 |
平衡常數 |
|
1 |
Au + 6HNO3(濃)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
從中可知,金很難與硝酸反應,但卻可溶于王水(濃硝酸與鹽酸按體積比1∶3的混合物),請你簡要解釋金能夠溶于王水的原因:
(2)濾液含量的測定: 以下是該小組探究濾液的一個實驗流程:

則100ml濾液中Fe2+的濃度為 mol·L-1
查看答案和解析>>
科目:高中化學 來源:09-10年江西四校高二下學期期中聯考化學卷 題型:填空題
(14分)已知粗銅中含有少量的鋅、鐵、銀、金等金屬和少量礦物雜質(雜質與酸不反應)。某化學興趣小組在實驗室條件下以硫酸銅溶液為電解液,用電解的方法實現了粗銅的提純,并對陽極泥和電解液中金屬進行回收和含量測定。
步驟一:電解精制:電解時,粗銅應與電源的 _極相連,陰極上的電極反應式為
電解過程中,硫酸銅的濃度會 (選填:變大、不變、變小)。[來源:七彩教育網]步驟二:電解完成后,該小組同學按以下流程對電解液進行處理:

(1)陽極泥的綜合利用:
稀硝酸處理陽極泥得到硝酸銀稀溶液,請你寫出該步反應的離子方程式:
。
殘渣含有極少量的黃金。為了回收金,他們查閱了有關資料(見下表):
|
序號 |
反應 |
化學平衡常數 |
|
1 |
Au
+ 6HNO3(濃) |
<< 1 |
|
2 |
Au3+ + 4Cl- = AuCl4- |
>>1 |
從資料中可知,金很難與硝酸反應,但卻可溶于王水(濃硝酸與鹽酸按體積比1∶3的混合物),請你從化學平衡移動的角度簡要解釋金能夠溶于王水的原因
。
(2)濾液含量的測定:以下是該小組探究濾液的一個實驗流程:

則100mL濾液中Cu2+ 的濃度為 mol·L-1 ,Fe2+的濃度為 mol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com