
【題目】已知:2Fe+3Br2=2FeBr3,Fe2+的還原性大于Br-。現有16.8 g鐵和0.3 mol Br2反應后加入水得到澄清溶液后,通入a mol Cl2。則下列敘述不正確的是
A. 當a=0.1時,發生的反應為2Fe2++Cl2=2Fe3++2Cl-
B. 當a=0.45時,發生的反應為2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. 若溶液中Br-有一半被氧化時,c(Fe3+)∶c(Br-)∶c(Cl-)=1∶1∶3
D. 當0<a<0.15時,始終有2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
【答案】C
【解析】n(Fe)=![]() =0.3mol,n(Br2)=0.3mol,由反應2Fe+3Br2═2FeBr3可知,反應后Fe過量,在溶液中進一步發生Fe+2Fe3+=3Fe2+,則反應后溶液中存在0.3molFe2+和0.6molBr-。A.當a=0.1時,氯氣不足,因Fe2+的還原性大于Br-,只發生2Fe2++Cl2═2Fe3++2Cl-,反應后Fe2+還有剩余,故A正確;B.當a=0.45時,首先發生2Fe2++Cl2═2Fe3++2Cl-,此時Fe2+完全反應,消耗0.15molCl2,剩余0.3molCl2,進一步發生2Br-+Cl2═Br2+2Cl-,又知Br-為0.6mol,則二者恰好反應,所以總方程式為2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B正確;C.若溶液中Br-有一半被氧化時,首先發生2Fe2++Cl2═2Fe3++2Cl-,此時Fe2+完全反應,消耗0.15molCl2,又知Br-為0.6mol,Br-有一半被氧化,則反應0.3mol,由方程式2Br-+Cl2═Br2+2Cl-,可知消耗0.15molCl2,則共消耗0.3mol氯氣,則c(Fe3+):c(Br-):c(Cl-)=0.3mol:0.3mol:0.6mol=1:1:2,故C錯誤;D.當0<a<0.15時,氯氣不足,溶液中存在Fe2+和Fe3+,由電荷守恒可知2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-),故D正確;故選C。
=0.3mol,n(Br2)=0.3mol,由反應2Fe+3Br2═2FeBr3可知,反應后Fe過量,在溶液中進一步發生Fe+2Fe3+=3Fe2+,則反應后溶液中存在0.3molFe2+和0.6molBr-。A.當a=0.1時,氯氣不足,因Fe2+的還原性大于Br-,只發生2Fe2++Cl2═2Fe3++2Cl-,反應后Fe2+還有剩余,故A正確;B.當a=0.45時,首先發生2Fe2++Cl2═2Fe3++2Cl-,此時Fe2+完全反應,消耗0.15molCl2,剩余0.3molCl2,進一步發生2Br-+Cl2═Br2+2Cl-,又知Br-為0.6mol,則二者恰好反應,所以總方程式為2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B正確;C.若溶液中Br-有一半被氧化時,首先發生2Fe2++Cl2═2Fe3++2Cl-,此時Fe2+完全反應,消耗0.15molCl2,又知Br-為0.6mol,Br-有一半被氧化,則反應0.3mol,由方程式2Br-+Cl2═Br2+2Cl-,可知消耗0.15molCl2,則共消耗0.3mol氯氣,則c(Fe3+):c(Br-):c(Cl-)=0.3mol:0.3mol:0.6mol=1:1:2,故C錯誤;D.當0<a<0.15時,氯氣不足,溶液中存在Fe2+和Fe3+,由電荷守恒可知2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-),故D正確;故選C。


科目:高中化學 來源: 題型:
【題目】常溫下,鹽酸與氫氧化鈉溶液相互滴定的滴定曲線如下圖,下列敘述不正確的是
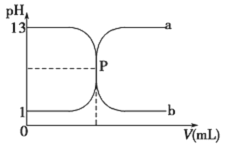
A. 滴定過程的任何時刻都存在:c(H+)+ c(Na+)=c(OH-)+c(Cl-)
B. 曲線b是用氫氧化鈉溶液滴定鹽酸溶液的滴定曲線
C. 氫氧化鈉溶液的物質的量濃度為0.1molL-1
D. P點時恰好完全中和,溶液呈中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】烏洛托品在合成、醫藥、染料等工業中有廣泛用途,其結構式如圖所示。將甲醛水溶液與氨水混合蒸發可制得烏洛托品。若原料完全反應生成烏洛托品,則甲醛與氨的物質的量之比為

A. 3:2 B. 2:3 C. 1:1 D. 2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式正確的是( )
A. 表示硫的燃燒熱的熱化學方程式S(s)+![]() O2(g)=SO3(g);ΔH=-315 kJ·mol-1
O2(g)=SO3(g);ΔH=-315 kJ·mol-1
B. 表示中和熱的熱化學方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.3 kJ·mol-1
C. 表示H2燃燒熱的熱化學方程式H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
D. 表示CO燃燒熱的熱化學方程式2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素在周期表中的位置如圖,其中只有M為金屬元素.下列說法不正確的是( ) 
A.原子半徑Z<M
B.Y的最高價氧化物對應水化物的酸性比X的弱
C.X的最簡單氣態氫化物的熱穩定性比Z的小
D.Z位于元素周期表中第2周期第ⅥA族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】霧霾天氣是一種大氣污染狀態,霧霾的源頭多種多樣,比如汽車尾氣、工業排放、建筑揚塵、垃圾焚燒,甚至火山噴發等。
(1)汽車尾氣中的NO(g)和CO(g)在一定溫度和催化劑的條件下可凈化。
①已知部分化學鍵的鍵能如下

請完成汽車尾氣凈化中NO(g)和CO(g)發生反應的熱化學方程式
2NO(g)+2CO( g) ![]() N2( g)+2CO2(g) △H=___________kJ·mol—1
N2( g)+2CO2(g) △H=___________kJ·mol—1
②若上述反應在恒溫、恒容的密閉體系中進行,并在t1時刻達到平衡狀態,則下列示意圖符合題意的是 ___(填選項序號)。(下圖中V正、K、n、P總分別表示正反應速率、平衡常數、物質的量和總壓強)

(2)在t1℃下,向體積為10 L的恒容密閉容器中通入NO和CO,測得不同時間NO和CO的物質的量如下表:

t1℃時該反應的平衡常數K= _______,既能增大反應速率又能使平衡正向移動的措施是
____。(寫出一種即可)
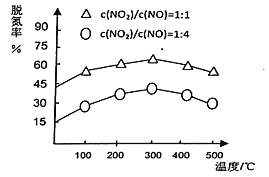
(3)NH3催化還原氮氧化物(SCR)技術是目前應用最廣泛的煙氣氮氧化物脫除技術。在氨氣足量的情況下,不同c(NO2)/C(NO)、不同溫度對脫氮率的影響如圖所示(已知氨氣催化還原氮氧化物的正反應為放熱反應),請回答溫度對脫氮率的影響____________________,給出合理的解釋:____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關合理用藥的下列說法中,錯誤的是( )
A. 對癥下藥是合理用藥的首要原則
B. 能被充分、快速吸收而無刺激性的藥物,可在飯前口服
C. 一種藥物的用量,是經過嚴格的科學實驗和大量的臨床研究確定的
D. 因為青霉素能夠殺菌,所以過期的青霉素仍然能夠使用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 純凈水中不含任何物質
B. 營養強化劑吃的越多越好
C. 可用燃燒的方法鑒別真絲圍巾和合成纖維圍巾
D. 由于微量元素的含量非常少,因此對人體健康的影響也很小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一容積不變的密閉容器中充入一定量A和B,發生如下反應:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定條件下,容器中A、C的物質的量濃度隨時間變化的曲線如圖所示。請回答下列問題:
yC(g) ΔH<0,一定條件下,容器中A、C的物質的量濃度隨時間變化的曲線如圖所示。請回答下列問題:

(1)用A的濃度變化表示該反應在0~10 min內的平均反應速率v(A)=______________________。
(2)根據圖示可確定x∶y=________。
(3)0~10 min容器內壓強________(填“變大”、“不變”或“變小”)。
(4)推測第10 min引起曲線變化的反應條件可能是______________________;第16min引起曲線變化的反應條件可能是________________________。
①減壓 ②增大A的濃度 ③增大C的量 ④升溫⑤降溫 ⑥加催化劑
(5)若平衡Ⅰ的平衡常數為K1,平衡Ⅱ平衡常數為K2,則K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com