



科目:高中化學 來源: 題型:
| A、鋁與鹽酸反應:Al+6H+═Al3++3H2↑ |
| B、CO2通入足量NaOH溶中:CO2+2OH-═CO32-+H2O |
| C、澄清石灰水與鹽酸反應:Ca(OH)2+2H+═2H2O+Ca2+ |
| D、碳酸鈉與氯化鈣混合:Na2CO3+Ca2+═CaCO3↓+2Na+ |
查看答案和解析>>
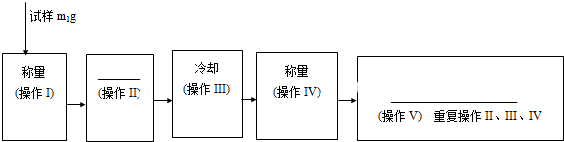
科目:高中化學 來源: 題型:
查看答案和解析>>
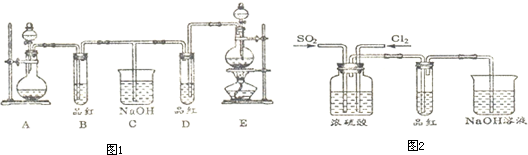
科目:高中化學 來源: 題型:
| △ |

查看答案和解析>>
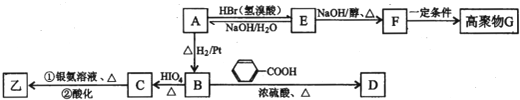
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
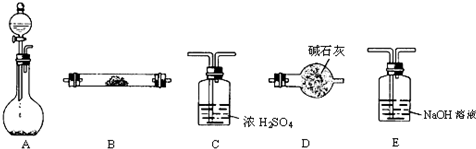
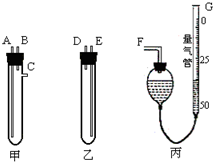 某中學化學實驗室要求學生在實驗室條件下,用標準卷尺、中學化學實驗室常用的托盤天平和如圖所示的儀器,再用稀硫酸和寬度、厚度均勻的純鎂帶(鎂帶每米質量為2.5g左右)測定氣體摩爾體積.假如實驗是在標準狀況下進行,試回答下列問題:
某中學化學實驗室要求學生在實驗室條件下,用標準卷尺、中學化學實驗室常用的托盤天平和如圖所示的儀器,再用稀硫酸和寬度、厚度均勻的純鎂帶(鎂帶每米質量為2.5g左右)測定氣體摩爾體積.假如實驗是在標準狀況下進行,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
 ,在某次合成反應中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知該次合成反應的速率是快的,試判斷導致其產率低的原因是( )
,在某次合成反應中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知該次合成反應的速率是快的,試判斷導致其產率低的原因是( )| A、使用了過量的氧化劑 |
| B、沒有用乙酸,而是使用了其它催化劑 |
| C、把反應混合物加熱 |
| D、所生成的甲萘醌是沉淀物 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
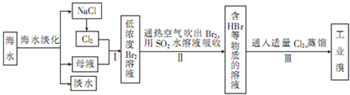
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com