
【題目】一定條件下,將SO2和O2充入一密閉容器中,發生如下反應:2SO2(g)+O2(g)![]() 2SO3(g)(正反應放熱)反應過程中SO2、O2、SO3物質的量變化如圖所示。回答下列問題:
2SO3(g)(正反應放熱)反應過程中SO2、O2、SO3物質的量變化如圖所示。回答下列問題:

(1)降低溫度,化學反應速度_________。(填“增大”“減小”或“不變”)
(2)反應處于平衡狀態的時間是____ _____。
(3)反應進行至20 min時,曲線發生變化的原因是______________________(用文字表達)。10 min到15 min的曲線變化的原因可能是_________(填寫編號)。
a.加了催化劑
b.縮小容器體積
c.降低溫度
d.增加SO3的物質的量
【答案】減小 15~20 min、25~30 min 增加了O2的量 ab
【解析】
試題分析:(1)降低溫度反應速率減小。
(2)在一定條件下,當可逆反應中正反應速率和逆反應速率相等時(但不為0),各種物質的濃度或含量均不再發生變化的狀態,是化學平衡狀態,所以根據圖像可知,處于平衡狀態的是15~20min,25~30min。
(3)反應進行至20 min時,氧氣的濃度突然增大,而SO2的濃度逐漸減小,三氧化硫的濃度逐漸增大,所以改變的條件是增大氧氣的濃度;根據圖像可知,10 min到15 min時,物質的濃度變化量增大,即反應速率加快,所以改變的條件是使用了催化劑或改變了壓強,答案選ab。


科目:高中化學 來源: 題型:
【題目】下列各粒子:①H3O+、NH4+、Na+;②OH-、NH2-、F-;③O2-、Na+、Mg2+;④CH4、NH3、H2O具有相同質子數和電子數的一組是
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述錯誤的是( )
A. 離子鍵沒有方向性和飽和性,而共價鍵有方向性和飽和性
B. 離子鍵的強弱主要決定于離子半徑和離子所帶電荷數
C. 配位鍵在形成時,由成鍵雙方各提供一個電子形成一對共用電子
D. 金屬鍵的實質是金屬中的自由電子與金屬陽離子形成的一種強烈的相互作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫恒容下,將2mol氣體A和2mol氣體B通入體積為2L的密閉容器中,發生如下反應:2A(g)+B(g)![]() xC(g)+2D(s),2min后反應達到平衡狀態,此時剩余1.2mol B,并測得C的濃度為1.2mol/L。
xC(g)+2D(s),2min后反應達到平衡狀態,此時剩余1.2mol B,并測得C的濃度為1.2mol/L。
(1)從開始反應至達到平衡狀態,生成C的平均反應速率為 。
(2)x= 。
(3)A的轉化率與B的轉化率之比為 。
(4)下列各項可作為該反應達到平衡狀態的標志是 (填字母)。
A.壓強不再變化
B.氣體密度不再變化
C.氣體平均相對分子質量不再變化
D.A的消耗速率與B的消耗速率之比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
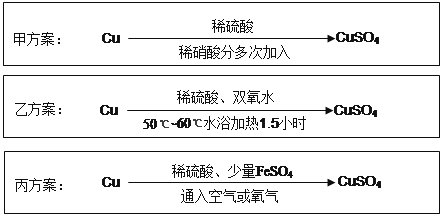
【題目】實驗室用銅制備CuSO 4 溶液有多種方案,某實驗小組給出了以下三種方案:
請回答有關問題:
(1)甲方案:
①寫出該反應的離子方程式 ;
②為了節約原料,硫酸和硝酸的物質的量之比最佳為,n(H 2 SO 4 ):n(HNO 3 )= 。
(2)乙方案:將6.4g銅絲放到90mL 1.5mol·L -1 的稀硫酸中,控溫在50℃。加入40mL 10%的H2O2,反應0.5小時,升溫到60℃,持續反應1小時后,經一系列操作,得CuSO 4·5H 2O 20.0g【已知有關摩爾質量:M(Cu)=64g/mol, M(CuSO4·5H 2 O) =250g/mol】。
①反應時溫度控制在50℃~60℃,不宜過高的原因是 ;
②本實驗CuSO4·5H 2 O的產率為 。
(3)丙方案:將空氣或氧氣直接通入到銅粉與稀硫酸的混合物中,發現在常溫下幾乎不反應。向反應液中加少量FeSO 4 ,即發生反應,生成硫酸銅。反應完全后,加物質A調節pH至4 ,然后過濾、濃縮、結晶。
①物質A可選用以下的 (填序號);
A.CaO
B.NaOH
C.CuCO 3
D.Cu 2(OH)2CO 3
E.Fe2(SO4) 3
②反應中加入少量FeSO 4 可加速銅的氧化,FeSO 4 的作用是 ;
反應過程中的的離子方程式為: 、
(4)對比甲、乙、丙三種實驗方案,丙方案的優點有(寫兩條): 、 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃酮類化合物具有抗腫瘤活性,6-羥基黃酮衍生物的合成路線如下:
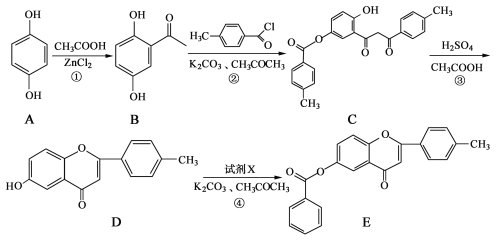
請回答下列問題:
(1)化合物B中的含氧官能團為 和 (填名稱)。
(2)反應③中涉及到的反應類型有水解反應、 和 。
(3)反應④中加入的試劑X的分子式為C7H5OCl,X的結構簡式為 。
(4)B的一種同分異構體滿足下列條件:
Ⅰ.能發生銀鏡反應,其水解產物之一能與FeCl3溶液發生顯色反應。
Ⅱ.分子中有4種不同化學環境的氫。
寫出該同分異構體的結構簡式: 。
(5)已知: 。根據已有知識并結合相關信息,寫出以
。根據已有知識并結合相關信息,寫出以![]() 和CH3COOH為原料制備
和CH3COOH為原料制備![]() 的合成路線流程圖(無機試劑任選)。合成路線流程圖示例如下:
的合成路線流程圖(無機試劑任選)。合成路線流程圖示例如下:
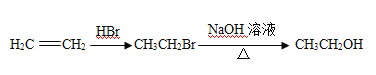
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、Q、R是五種短周期元素,原子序數依次增大。X、Y兩元素最高正價與最低負價之和均為0;Q與X同主族;Z、R分別是地殼中含量最高的非金屬元素和金屬元素。
請回答下列問題:
(1)寫出R的原子結構示意圖:________________
(2)五種元素原子半徑由大到小的順序是(寫元素符號) .
(3)X與Y能形成多種化合物其中既含極性鍵又含非極性鍵,且相對分子質量最小的物質是(寫分子式) ,X和Z組成的化合物的化學式為___________________
(4)由以上某些元素組成的化合物A、B、C、D有如下轉化關系:A![]() B(在水溶液中進行),其中,C是溶于水顯酸性的氣體;D是淡黃色固體。寫出C的化學式 ;D的電子式 .
B(在水溶液中進行),其中,C是溶于水顯酸性的氣體;D是淡黃色固體。寫出C的化學式 ;D的電子式 .
①如果A、B均由三種元素組成,B為兩性不溶物,則A![]() B離子反應方程式為_________
B離子反應方程式為_________
②A、B均為鹽溶液,如果A由三種元素組成,B由四種元素組成,A、B溶液均顯堿性.用離子方程式表示A溶液顯堿性的原因 ;常溫下,在該溶液中滴加稀鹽酸至中性時,溶質的主要成分有 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com