
【題目】V L濃度為0.5 mol·L-1的鹽酸,欲使其濃度增大1倍,采取的措施合理的是( )
A.通入標準狀況下的HCl氣體11.2V L
B.加入10 mol·L-1的鹽酸0.1V L,再稀釋至1.5V L
C.將溶液加熱濃縮到0.5V L
D.加入V L 1.5 mol·L-1的鹽酸混合均勻
科目:高中化學 來源: 題型:
【題目】
(1)1.5molCO2的質量是,在標準狀況下的體積為,所含氧原子的數目為。(2)現有質量比為11:14的CO2和CO的混合氣體,則該混合氣體中的CO2和CO物質的量之比為,碳原子和氧原子的個數比為,該混合氣體的摩爾質量為。(3)向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化鋇溶液,生成沉淀的質量為6.27g,向所得沉淀中加入足量稀鹽酸,沉淀質量減少到2.33g,并放出氣體,試計算:
原混合物中Na2SO4的物質的量濃度;
在標準狀況下產生氣體的體積。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D分別是NaNO3、NaOH、HNO3和Ba(NO3)2四種溶液中的一種。現利用另一種溶液X,用如下圖所示的方法即可將它們確定。

試確定A,B,C,D,X各代表何種溶液。
A:___________B:___________C:___________D:___________X:___________
寫出加過量的A產生白色沉淀的化學方程式:_________________________________。
寫出加過量的C產生白色沉淀的化學方程式:_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:Fe(OH)3和Al(OH)3沉淀的生成與溶解的量如下表。

向FeCl3、Al2(SO4)3的混合溶液中逐有加入Ba(OH)2溶液,形成沉淀的情況如下圖所示.以下推斷錯誤的是

A.AB段可能發生的反應:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C點對應的沉淀:Fe(OH)3和BaSO4
C.OA段可能發生的反應:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.據圖計算原溶液中:c(Cl-)=c(SO42-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綜合題:
氫氣是清潔的能源,也是重要的化工原料,根據以下三種制氫方法。完成下列問題:
(1)方法一:H2S熱分解法,反應式為:2H2S(g)![]() 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密閉容器中,測定H2S分解的轉化率(H2S的起始濃度均為cmol/L),測定結果見下圖,圖中曲線a表示H2S的平衡轉化率與溫度關系,曲線b表示不同溫度下反應經過相同時間未達到化學平衡時H2S的轉化率。
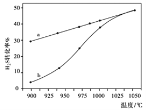
①△H0,(“>”、“<”或“=”)。
②若985℃時,反應經tmin達到平衡,此時H2S的轉化率為40%,則tmin內反應速率v(H2)=
(用含c、t的代數式表示)。
③請說明隨溫度的升高,曲線b向曲線a接近的原因:。
(2)方法二:以CaO為吸收體,將生物材質(以C計)與水蒸氣反應制取H2。相關主要反應如下:
I:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H=-178.3kJ/mol
①計算反應C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=kJ/mol;
CaCO3(s)+2H2(g)的△H=kJ/mol;
若K1、K2、K3分別為反應I、Ⅱ、Ⅲ的平衡常數,該平衡常數K=(用K1、K2、K3表示)。
②對于可逆反應C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2產率的是。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2產率的是。(填字母)
A.降低體系的溫度
B.壓縮容器的體積
C.增加CaO的量
D.選用適當的催化劑
(3)方法三:利用甲醇可以與水蒸氣反應制取H2,反應方程式如下:
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49.4kJ/mol
CO2(g)+3H2(g)△H=+49.4kJ/mol
一定溫度下,向容積為2L的密閉恒容容器中充入1molCH3OH(g)和3molH2O(g),達到平衡狀態時,吸收熱量19.76kJ。則
①達平衡時混合氣體的壓強是反應前的倍。
②此溫度下的該反應的平衡常數是(保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組數據中,前者剛好是后者兩倍的是
A.2mol水和1mol水的摩爾質量
B.1mol·L-1CaCl2溶液與2mol·L-1KCl溶液中Cl-的物質的量
C.50Ml.1mol·L-1MgCl2溶液與100Ml.1mol·L-1NaCl溶液中Cl-物質的量濃度
D.20%NaOH溶液與10%NaOH溶液中NaOH的物質的量濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為除去粗鹽中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下所示(用于沉淀的試劑稍過量):
![]()
(1)檢驗粗鹽中存在SO42-的方法是(用化學方程式表示)_______________,第①步操作的名稱是______________。
(2)第④步中加入試劑的化學式為_____________________。
(3)第⑦步操作所需要玻璃儀器的名稱是___________。
(4)若⑤步、第⑥步順序顛倒,將對實驗結果產生影響,其原因是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
(1)3.6gH2O物質的量為______mol,約含有_________個原子。
(2)已知1.204×1023個X氣體的質量是6.4g。則X氣體的摩爾質量是______。
(3)2molNH3與_________L(標準狀況)CH4所含氫原子數目相同。
(4)同溫同壓下,同體積的甲烷(CH4)和CO2分子數之比為________,物質的量之比_______,原子總數之比_________,質量之比為________,密度之比_________。
(5)VLAl2(SO4)溶液中含Al3+amol,溶液的物質的量濃度為__________,取出V/2L再加入水稀釋到4VL。則稀釋后溶液中SO42-的物質的量濃度是__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com