下列敘述正確的是( )
A.標準狀況下,22.4L水中所含的分子數約為6.02×1023
B.1.00molNaCl中,所有Na+的最外層電子總數為8×6.02×1023
C.欲配置1.00L,1.00mol.L-1的NaCl溶液,可將58.5gNaCl溶于1.00L水中
D.22g二氧化碳與標準狀況下11.2L氯化氫氣體含有的分子數不同
【答案】
分析:A.標準狀況下,水為液態;
B.Na
+的最外層電子數為8;
C.溶液的體積不等于溶劑的體積;
D.根據n=
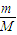
=
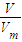
=
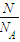
判斷.
解答:解:A.標準狀況下,水為液態,V
m≠22.4L/mol,無法計算水的物質的量,故A錯誤;
B.Na
+的最外層電子數為8,則1.00molNaCl中,所有Na
+的最外層電子總數為8×6.02×10
23,故B正確;
C.溶液的體積不等于溶劑的體積,將58.5gNaCl溶于1.00L水中,所得溶液的體積不等于1L,c(NaCl)≠1mol/L,故C錯誤;
D.n(CO
2)=
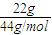
=0.5mol,n(HCl)=
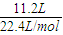
=0.5mol,二者的物質的量相同,則含有的分子數相同,故D錯誤.
故選B.
點評:本題考查阿伏加德羅常數,題目難度不大,注意物質存在的條件、聚集狀態以及物質的性質等因素,易錯點為C,注意溶液的體積不等于溶劑的體積.

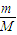 =
=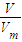 =
=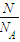 判斷.
判斷.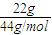 =0.5mol,n(HCl)=
=0.5mol,n(HCl)=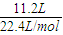 =0.5mol,二者的物質的量相同,則含有的分子數相同,故D錯誤.
=0.5mol,二者的物質的量相同,則含有的分子數相同,故D錯誤.
