
【題目】探究鐵在某濃度H3PO4和H2O2的混合溶液中反應的情況,進行如下實驗:
實驗 | 操作 | 現象 |
Ⅰ | 將除去氧化膜的鐵釘置于燒杯中,加入30mL1.0molL-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段時間后鐵釘表面突然產生大量氣泡,隨后停止產生氣泡;一段時間后再產生大量氣泡,再停止,出現周而往復的現象。過程中,溶液保持澄清。
|
Ⅱ | 將與實驗Ⅰ相同的鐵釘放入燒杯中,加入30mL1.0molL-1H3PO4和3mLH2O。 | 片刻后鐵釘表面持續產生氣泡,溶液保持澄清。 |
已知:Fe3(PO4)2難溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃儀器有量筒、燒杯、玻璃棒、膠頭滴管、______。
(2)請結合實驗Ⅱ中現象,分析鐵釘與H3PO4反應的產物_______。
(3)探究實驗Ⅰ中停止產生氣泡的原因。
提出假設:鐵釘表面形成了含有+3價鐵的氧化膜將鐵釘覆蓋。甲同學進行實驗Ⅲ,得出假設成立的結論。
實驗Ⅲ:將洗凈的實驗Ⅰ中無氣泡產生時的鐵釘置于試管中,加入滴有KSCN溶液的稀H2SO4,振蕩,靜置,溶液呈紅色。
乙同學認為實驗Ⅲ無法證實假設成立,其理由是未排除O2的干擾,請解釋O2是如何干擾實驗的:_____。
乙同學通過改進實驗證實了假設成立。
(4)鐵釘表面突然產生大量氣泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在鐵釘表面的H2脫離鐵釘表面。形成氧化膜(以Fe3O4計)的離子方程式是____。
(5)實驗Ⅰ中周而往復的現象與鐵釘表面氧化膜的生成和溶解密切相關,從反應的速率角度分析其原因:______。
【答案】100mL容量瓶 Fe+2H3PO4=Fe(H2PO4)2+H2↑ 氧氣在酸性條件下可以將亞鐵離子氧化成鐵離子,發生反應4Fe2++O2+4H+=4Fe3++2H2O 3Fe2++H2O2+2H2O=Fe3O4+6H+ 鐵與磷酸反應生成氫氣和Fe2+,Fe2+在鐵釘表面迅速被氧化形成氧化膜,使聚集在鐵釘表面的氫氣脫離;隨后發生磷酸溶解氧化膜的慢反應,氧化膜覆蓋鐵釘表面時不產生氣泡,當氧化膜溶解后,鐵又與磷酸反應產生氫氣
【解析】
題目是進行探究性實驗,在實驗Ⅰ中,鐵釘表面產生氣泡,是因為鐵與H3PO4反應生成氫氣,因為溶液保持澄清,根據信息可知還生成了溶于水的Fe(H2PO4)2,一段時間后再產生大量氣泡,再停止,出現周而往復的現象,與實驗Ⅱ對比可知是H2O2發生了作用,結合題目信息可知雙氧水可將亞鐵離子氧化成鐵離子形成氧化膜,使聚集在鐵釘表面的氫氣脫離;隨后發生磷酸溶解氧化膜的慢反應,氧化膜覆蓋鐵釘表面時不產生氣泡,當氧化膜溶解后,鐵又與磷酸反應產生氫氣。
(1)配制100mL1.0mol·L-1H3PO4所用的玻璃儀器有量筒、燒杯、玻璃棒、膠頭滴管、100mL容量瓶;
(2)在實驗Ⅰ中,鐵釘表面產生氣泡,是因為鐵與H3PO4反應生成氫氣,因為溶液保持澄清,根據信息可知還生成了Fe(H2PO4)2,化學方程式為Fe+2H3PO4=Fe(H2PO4)2+H2↑;
(3)氧氣在酸性條件下可以將亞鐵離子氧化成鐵離子,發生反應4Fe2++O2+4H+=4Fe3++2H2O,故實驗Ⅲ無法證實假設成立;
(4)亞鐵離子被H2O2溶液形成氧化為Fe3O4,根據電子守恒和元素守恒可得離子方程式為:3Fe2++H2O2+2H2O=Fe3O4+6H+;
(5)根據分析可知原因為:鐵與磷酸反應生成氫氣和Fe2+,Fe2+在鐵釘表面迅速被氧化形成氧化膜,使聚集在鐵釘表面的氫氣脫離;隨后發生磷酸溶解氧化膜的慢反應,氧化膜覆蓋鐵釘表面時不產生氣泡,當氧化膜溶解后,鐵又與磷酸反應產生氫氣,


 口算能手系列答案
口算能手系列答案科目:高中化學 來源: 題型:
【題目】燃料電池是目前電池研究的熱點之一。某課外小組自制的氫氧燃料電池如圖所示,a、b均為惰性電極,下列敘述錯誤的是( )
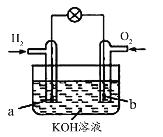
A.a極是負極,該電極上發生氧化反應
B.b極發生的電極反應是O2+4OH――4e-=2H2O
C.電池總反應方程式為2H2+O2=2H2O
D.溶液中OH-向正極移動,K+、H+向負極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2-二溴乙烷可作汽油抗爆劑的添加劑,常溫下它是無色液體,不溶于水,易溶于醇等有機溶劑。實驗室制備1,2-二溴乙烷的反應原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在濃硫酸存在下在140℃脫水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②實驗中常因溫度過高而使乙醇和濃硫酸反應生成少量SO2和CO2,用12.0g溴和足量的乙醇制備1,2-二溴乙烷,實驗裝置如圖所示:
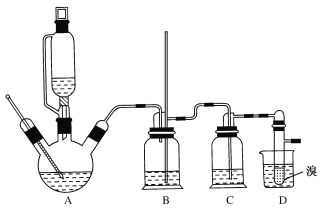
有關數據列表如下:
類別 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
狀態 | 無色液體 | 無色液體 | 無色液體 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸點/℃ | 78.5 | 132 | 34.6 |
熔點/℃ | -130 | 9 | -116 |
回答下列問題:
(1)在此制備實驗中,A中按最佳體積比3﹕1加入乙醇與濃硫酸后,A中還要加入幾粒碎瓷片,其作用是___。要盡可能迅速地把反應溫度提高到170℃左右,其最主要目的是___。
(2)裝置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,還可判斷裝置是否堵塞,若堵塞,B中現象是____。
(3)在裝置C中應加入NaOH溶液,其目的是____。
(4)裝置D中小試管內盛有液溴,判斷該制備反應已經結束的最簡單方法是___。
(5)將1,2—二溴乙烷粗產品置于分液漏斗中加水,振蕩后靜置,產物應在___層(填“上”或“下”)。若產物中有少量未反應的Br2,最好用___洗滌除去;若產物中有少量副產物乙醚,可用____(填操作方法名稱)的方法除去。
(6)反應過程中應用冷水冷卻裝置D,其主要目的是乙烯與溴反應時放熱,冷卻可避免溴的大量揮發;但又不能過度冷卻(如用冰水),其原因是___。
(7)若實驗結束后得到9.4g產品,1,2—二溴乙烷的產率為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通常監測SO2含量是否達到排放標準的反應原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。設NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.0.1molBaCl2晶體中所含離子總數為0.2NA
B.25℃時,pH=1的HC1溶液中含有H+的數目為0.1NA
C.17gH2O2中含有非極性鍵數目為0.5NA
D.生成2.33gBaSO4沉淀時,轉移電子數目為0.01NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化鈧(Sc2O3)在合金、電光源、催化劑、激活劑和陶瓷等領域有廣泛的應用,利用鈧精礦為原料(主要成分為Sc2O3,還含有Fe2O3、MnO等雜質)生產氧化鈧的一種工藝流程如下:
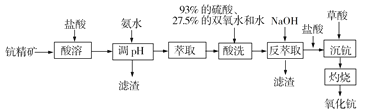
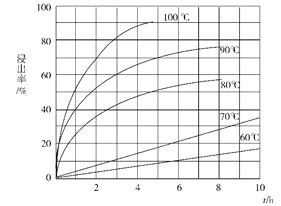
(1)“酸溶”步驟中,鈧的浸出率結果如圖所示。由圖可知,為使鈧的浸出率達90%左右,所采用的生產條件為___________________。
(2)加入氨水調節pH=3,過濾,濾渣主要成分是_____________;若再向濾液加入氨水調節pH=6,濾液中 Sc3+能否沉淀完全(離子濃度小于105 mol/L)?______________(列式計算并作判斷)。(25℃時,Ksp[Mn(OH)2]=1.9×1013、Ksp[Fe(OH)3]=2.6×1039,Ksp[Sc(OH)3]=9.0×1031)
(3)已知鈧與鋁類似,其氫氧化物具有兩性。反萃取步驟中,加入NaOH使溶液呈堿性,堿性條件下雙氧水可以氧化錳離子生成濾渣,寫出該反應的離子方程式______________。
(4)“沉鈧”前先加入稀鹽酸調節溶液至酸性,然后用草酸“沉鈧”。25℃時pH=2的草酸溶液中![]() =_________________________。寫出“沉鈧”得到草酸鈧(難溶于稀酸)的離子方程式___________________[25℃時,草酸電離平衡常數為Ka1=5.0×102,Ka2=5.4×105]。
=_________________________。寫出“沉鈧”得到草酸鈧(難溶于稀酸)的離子方程式___________________[25℃時,草酸電離平衡常數為Ka1=5.0×102,Ka2=5.4×105]。
(5)草酸鈧“灼燒”的化學方程式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在常溫下,有下列五種溶液:
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4
④0.1mol/LNH4HCO3 ⑤0.1mol/LNaHCO3
請根據要求填寫下列空白:
(1)溶液①呈 ______ 性(填“酸”、“堿”或“中”),其原因是: ______ (用離子方程式表示)
(2)溶液⑤呈 ______ 性(填“酸”、“堿”或“中”),其原因是: ______ (用離子方程式表示)
(3)比較溶液①、③中c(NH4+)的大小關系是① ______ ③(填“>”、“<”或“=”)
(4)常溫下,測得溶液②的pH=7,則CH3COO-的水解程度 ______ NH4+的水解程度(填“>”、“<”或“=”),CH3COO-與NH4+濃度的大小關系是:c(CH3COO-)_____c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子,在指定的環境中一定能大量共存的是( )
A.某無色酸性溶液中:NH![]() 、Ca2+、F-、Cl-
、Ca2+、F-、Cl-
B.與金屬鋁反應只放出氫氣的溶液:K+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-
C.能使淀粉碘化鉀試紙變藍的溶液中:Na+、NH![]() 、S2-、Br-
、S2-、Br-
D.滴加酚酞試液變紅色的溶液:K+、Na+、S2-、Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某種含有少量氧化鈉的過氧化鈉試樣(已知試樣質量為1.560g、錐形瓶和水的質量為190.720g),利用如圖裝置測定混合物中Na2O2的質量分數,每隔相同時間讀得電子天平的數據如下表:
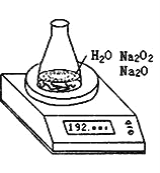

(1)寫出Na2O2和H2O反應的化學方程式_______。
(2)計算過氧化鈉質量分數時,除了試樣的質量,錐形瓶和水的質量,還必需的數據是______,不必作第6次讀數的原因是______。
(3)根據上述數據,過氧化鈉的質量分數是_____(保留2位小數)。
(4)測定上述樣品(1.560g)中Na2O2質量分數的另一種方案,其操作流程如圖:
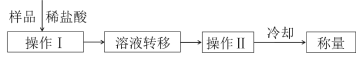
①操作Ⅰ的名稱是_____。
②需直接測定的物理量是_____。
③操作Ⅱ需要的儀器除了酒精燈,還需要_____(固定、夾持儀器除外)。
④在轉移溶液時,如溶液轉移不完全,則Na2O2質量分數的測定結果_____(填“偏大”、“偏小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語對事實的表述正確的是
A.電解CuCl2溶液:CuCl2=Cu2++2Cl-
B.Mg和Cl形成離子鍵的過程:![]()
C.向Al2(SO4)3溶液中滴加Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓
D.乙酸與乙醇發生酯化反應:CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com