
| A. | c(NH4+)>c(Cl-),c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+),c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+),c(H+)>c(OH-) | D. | c(NH4+)=c(Cl-),c(OH-)=c(H+) |
分析 用0.10mol•L-1的鹽酸滴定0.10mol•L-1的氨水,無論溶液中的溶質是氯化銨,還是氯化銨和氯化氫、氯化銨和一水合氨,所得溶液一定不顯電性,則利用遵循電荷守恒來分析解答.
解答 解:A.若滴定后溶液中的溶質為氯化銨和一水合氨,則一般溶液顯堿性,即c(OH-)>c(H+),溶液中弱電解質的電離>鹽的水解,即c(NH4+)>c(Cl-),符合電荷守恒,則A是可能出現的結果,故A錯誤;
B.當c(Cl-)>c(NH4+),c(OH-)>c(H+),則溶液中陰離子帶的電荷總數就大于陽離子帶的電荷總數,顯然與電荷守恒矛盾,故B是不可能出現的結果,則B正確;
C.若滴定后溶液中的溶質為氯化銨,由銨根離子水解則溶液顯酸性,即c(H+)>c(OH-),又水解的程度很弱,則c(Cl-)>c(NH4+),且符合電荷守恒,則C是可能出現的結果,故C錯誤;
D.若滴定后溶液中的溶質為氯化銨和一水合氨,當溶液中弱電解質的電離程度與鹽的水解程度相同時,溶液為中性,則c(OH-)=c(H+),由電荷守恒可知c(NH4+)=c(Cl-),則D是可能出現的結果,故D錯誤;
故選B.
點評 本題考查離子濃度大小比較,題目難度中等,明確電荷守恒的含義及鹽的水解原理為解答關鍵,注意掌握溶液酸堿性與溶液pH的關系,試題培養了學生的分析能力及靈活應用能力.


 快樂暑假暑假能力自測中西書局系列答案
快樂暑假暑假能力自測中西書局系列答案科目:高中化學 來源: 題型:解答題
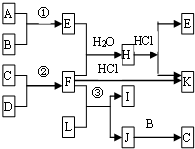 如圖是部分短周期元素的單質及其化合物的轉化關系圖
如圖是部分短周期元素的單質及其化合物的轉化關系圖| 溶液酸堿性 | 離子濃度大小順序 | |
| 1 | 酸性 | |
| 2 | 中性 | |
| 3 | 堿性 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
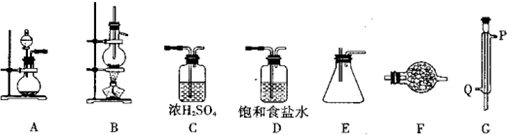
| 密度/(g•cm-3) | 熔點/℃ | 沸點/℃ | |
| 四氯化錫 | 2.2 | -33 | 114 |
| 金屬錫 | 5.77 | 231 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 [Al(OH)2]++H+.
[Al(OH)2]++H+.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強電解質在水溶液中的電離過程是不可逆的 | |
| B. | 強電解質的水溶液導電能力一定比弱電解質的水溶液導電能力強 | |
| C. | 易溶于水的電解質一定是強電解質 | |
| D. | 同一弱電解質溶液,溫度不同時,導電能力相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
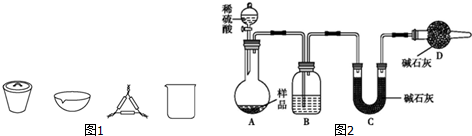
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 間二甲苯的二氯代物有5種 | |
| B. | 二氯甲烷有2種同分異構體 | |
| C. | 丙烯分子中所有的原子有可能在同一平面上 | |
| D. | 用-C4H9取代苯環上的1個氫原子,最多可得4種同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④②⑤③ | B. | ⑤②①④③ | C. | ②⑤④①③ | D. | ④①②⑤③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | Ⅰ | Ⅱ |
| 實驗一 | 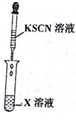  |  |
| 編號 | Ⅲ | |
| 實驗二 |  | |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com