
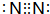 .
.分析 A、B、C、D、E為原子序數依次增大的短周期元素.D是地殼中含量最高的金屬元素,則D為Al;A、B組成的常見氣體甲能使濕潤的紅色石蕊試紙變藍,該氣體甲為NH3,則A為H元素、B為N元素;C、D、E處于同一周期,即處于第三周期,A、C處于同一主族,則C為Na;E原子的最外層電子數是A、B、C原子最外層電子數之和,則E原子最外層電子數為1+5+1=7,故E為Cl;E的單質與甲反應能生成B的單質,同時生成兩種水溶液均呈酸性的化合物乙和丙(該反應中氧化產物只有一種),25℃時0.1mol.L-l的乙溶液pH>l,則乙為NH4Cl、丙為HCl;D的單質既能與C元素最高價氧化物的水化物的溶液反應生成鹽丁,也能與丙的水溶液反應生成鹽,則丁為NaAlO2,據此解答.
解答 解:A、B、C、D、E為原子序數依次增大的短周期元素.D是地殼中含量最高的金屬元素,則D為Al;A、B組成的常見氣體甲能使濕潤的紅色石蕊試紙變藍,該氣體甲為NH3,則A為H元素、B為N元素;C、D、E處于同一周期,即處于第三周期,A、C處于同一主族,則C為Na;E原子的最外層電子數是A、B、C原子最外層電子數之和,則E原子最外層電子數為1+5+1=7,故E為Cl;E的單質與甲反應能生成B的單質,同時生成兩種水溶液均呈酸性的化合物乙和丙(該反應中氧化產物只有一種),25℃時0.1mol.L-l的乙溶液pH>l,則乙為NH4Cl、丙為HCl;D的單質既能與C元素最高價氧化物的水化物的溶液反應生成鹽丁,也能與丙的水溶液反應生成鹽,則丁為NaAlO2.
(1)甲的化學式為NH3,B單質為N2,電子式為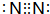 ,故答案為:NH3;
,故答案為:NH3;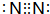 ;
;
(2)D元素的名稱是鋁,故答案為:鋁;
(3)NaAlO2溶液中通入過量二氧化碳時的離子方程式:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓,
故答案為:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
(4)在一定溫度下,在2L密閉容器中,2mol單質N2和1.6mol單質H2充分反應后達到平衡,測得NH3的物質的量濃度為0.4mol.L-l,則:
N2(g)+3H2(g)?2NH3(g)
起始濃度(mol/L):1 0.8 0
變化濃度(mol/L):0.2 0.6 0.4
平衡濃度(mol/L):0.8 0.2 0.4
該溫度下的平衡常數K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.{4}^{2}}{0.8×0.{2}^{3}}$=25,
故答案為:25;
(5)氯氣與氨氣反應生成的NH4Cl、HCl的物質的量之比為2:4,設二者物質的量分別為2mol、4mol,根據氯原子守恒被還原氯氣為$\frac{2mol+4mol}{2}$=3mol,根據電子轉移守恒被氧化的氨氣為$\frac{3mol×2}{3}$=2mol,則反應中被氧化的物質與被還原的物質的物質的量之比為2mol:3mol=2:3,
故答案為:2:3.
點評 本題考查結構性質位置關系應用,涉及元素化合物性質、電子式、化學平衡常數、氧化還原反應計算等,是對學生綜合能力的考查,難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙一定是弱堿 | B. | 甲一定是強堿 | C. | 乙一定是二元堿 | D. | 甲一定是一元堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,顏色變淺:2NO2(g)???N2O4(g)△H<0 (紅棕色) (無色) | |
| C. | 鐵溶于稀硝酸,溶液變黃:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe3++2NO↑+4H2O | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液變紅:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙酸的水溶液能使石蕊試液變紅 | B. | 乙酸能與水任意比互溶 | ||
| C. | 乙酸能與Na2CO3溶液反應,產生CO2 | D. | 乙酸鈉溶液的PH大于7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com