
| n |
| V |
| n |
| V |


科目:高中化學 來源: 題型:閱讀理解
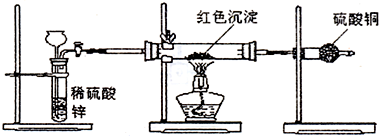
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 溫度溶解度鹽 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| c(V2-V1)M |
| 1000W |
| c(V2-V1)M |
| 1000W |
查看答案和解析>>
科目:高中化學 來源: 題型:
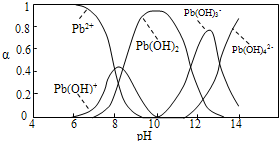
| c(Pb2+) |
| c(NO3-) |
| 1 |
| 2 |
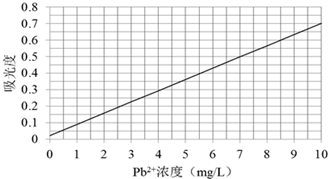
查看答案和解析>>
科目:高中化學 來源:2012-2013學年黑龍江省安三中高一上學期期中考試化學試卷(帶解析) 題型:實驗題
(10分)甲、乙兩人分別用不同的方法配制100 mL 3.6 mol/L的稀硫酸.
(1)甲:量取20 mL 18 mol/L濃硫酸,小心地倒入盛有少量水的燒瓶中,攪拌均勻,待冷卻至室溫后轉移到100 mL容量瓶中,用少量的水將燒杯等儀器洗滌2~3次,每次洗滌液也轉移到容量瓶中,然后小心地向容量瓶中加入水至刻線定容,塞好瓶塞,反復上下顛倒搖勻.
①實驗所用的玻璃儀器除燒杯和容量瓶外,還有__________________________ 。
②將溶液轉移到容量瓶中的正確操作是________________________________。
③定容的正確操作是_________________________________________。
(2)乙:用100 mL量筒量取20 mL 18 mol/L濃硫酸,并向其中小心地加入少量水,攪拌均勻,等冷卻至室溫后,再加入水至100 mL刻線,再攪拌均勻.你認為此法是否正確?若不正確,指出其中錯誤之處_________ 。
查看答案和解析>>
科目:高中化學 來源:2015屆黑龍江省高一上學期期中考試化學試卷(解析版) 題型:實驗題
(10分)甲、乙兩人分別用不同的方法配制100 mL 3.6 mol/L的稀硫酸.
(1)甲:量取20 mL 18 mol/L濃硫酸,小心地倒入盛有少量水的燒瓶中,攪拌均勻,待冷卻至室溫后轉移到100 mL容量瓶中,用少量的水將燒杯等儀器洗滌2~3次,每次洗滌液也轉移到容量瓶中,然后小心地向容量瓶中加入水至刻線定容,塞好瓶塞,反復上下顛倒搖勻.
①實驗所用的玻璃儀器除燒杯和容量瓶外,還有__________________________ 。
②將溶液轉移到容量瓶中的正確操作是________________________________。
③定容的正確操作是_________________________________________。
(2)乙:用100 mL量筒量取20 mL 18 mol/L濃硫酸,并向其中小心地加入少量水,攪拌均勻,等冷卻至室溫后,再加入水至100 mL刻線,再攪拌均勻.你認為此法是否正確?若不正確,指出其中錯誤之處_________ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com