
A是有機羧酸鹽,B、C、D是常見化合物; A、B、C、D焰色反應呈黃色,水溶液均呈堿性,其中B的堿性最強。X、Y是最常見的氧化物且與人體、生命息息相關,它們的晶體類型相同。A與B等物質的量反應生成D和一種氣體單質;C受熱分解得到Y、D和X;B與C反應生成D和X。E由兩種元素組成,式量為83,將E投入X中得到B和氣體Z,Z在標準狀況下的密度為0.76g·L-1。
(1)A的化學式是??????? ????? 。Y的電子式是?????? ??????? 。
(2)X的沸點比同主族同類型物質要高,原因是? ???????????? ? 。
(3)寫出E與足量鹽酸反應的化學方程式???????????
(4)寫出在D的飽和溶液中不斷通Y析出C的離子方程式???????????? ?????? 。
(5)A的一個重要應用是根據2A →P +H2↑得到P,P溶液中的陰離子通常用CaCl2使之沉淀,當它完全沉淀時,溶液中Ca2+的物質的量濃度至少為????????? 。
(沉淀Ksp=2.3×10-9,當溶液中離子濃度≤10-5mol·L-1,即可認為完全沉淀)
(6)實驗室常用P與足量HCl反應所得的有機物在濃硫酸條件下共熱分解制某還原性氣體,設計實驗證明分解產物中還原性氣體的存在?????????????????????????? 。
(1)HCOONa(2分)?????? 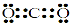 ???? (2分)
???? (2分)
(2)水分子間存在氫鍵(2分)??????
(3)Na3N+4HCl=3NaCl+NH4Cl(2分)
(4)2Na++CO32-+H2O+CO2==2NaHCO3↓(2分)
(5)2.3×10-4mol·L-1(2分)
(6)將所得氣體先通過足量NaOH溶液,再通過澄清石灰水,無現象,點燃剩余氣體,將事先用澄清石灰水潤濕過的燒杯倒置在火焰上方,燒杯內壁變渾濁,說明有還原性氣體CO的存在。(3分)(其它合理答案也給分)
【解析】
試題分析:① 已知A是有機羧酸鹽,B、C、D是常見化合物; A、B、C、D焰色反應呈黃色,水溶液均呈堿性。則可推知化合物A、B、C、D均為含有Na元素的堿或強堿弱酸鹽,B的堿性最強,則B為NaOH。② X、Y是最常見的氧化物且與人體、生命息息相關,它們的晶體類型相同,則X、Y應為H2O和CO2。③ 由C受熱分解得到Y、D和X;B與C反應生成D和X,可推知C為NaHCO3,D為Na2CO3 ;即2 NaHCO3 Na2CO3 +CO2↑+H2O; NaHCO3 +NaOH =Na2CO3 +H2O; 由此可確定X為H2O,Y為CO2。④ 由有機羧酸鹽A與NaOH等物質的量反應生成Na2CO3和一種氣體單質,可聯想到由無水醋酸鈉與NaOH加熱反應制取甲烷的脫羧反應:
Na2CO3 +CO2↑+H2O; NaHCO3 +NaOH =Na2CO3 +H2O; 由此可確定X為H2O,Y為CO2。④ 由有機羧酸鹽A與NaOH等物質的量反應生成Na2CO3和一種氣體單質,可聯想到由無水醋酸鈉與NaOH加熱反應制取甲烷的脫羧反應: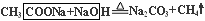 ,由此遷移可知,A為甲酸鈉(HCOONa),與等物質的量NaOH進行脫羧反應生成Na2CO3和氫氣:
,由此遷移可知,A為甲酸鈉(HCOONa),與等物質的量NaOH進行脫羧反應生成Na2CO3和氫氣: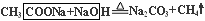 。 ⑤ E由兩種元素組成,式量為83,將E投入H2O中得到NaOH和氣體Z,Z在標準狀況下的密度為0.76g·L-1。由計算可知氣體Z的相對分子質量是17,則Z為NH3,由該反應:E + H2O → NaOH + NH3↑,可推知E由Na和N兩種元素組成,再根據元素化合價可確定E是Na3N。
。 ⑤ E由兩種元素組成,式量為83,將E投入H2O中得到NaOH和氣體Z,Z在標準狀況下的密度為0.76g·L-1。由計算可知氣體Z的相對分子質量是17,則Z為NH3,由該反應:E + H2O → NaOH + NH3↑,可推知E由Na和N兩種元素組成,再根據元素化合價可確定E是Na3N。
由此可解答:
(1)A的化學式是? HCOONa ;Y的電子式是 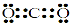
(2)X的沸點比同主族同類型物質要高的原因是:水分子間存在氫鍵,從而使分子間作用力增加,因此有較高的沸點。
(3)E與足量鹽酸反應的化學方程式:Na3N + 4HCl = 3NaOH + NH4Cl 。
(4)D的飽和溶液中不斷通入通Y析出C的離子方程式為:
2Na++CO32-+H2O+CO2 = 2NaHCO3↓
(5)根據2A →P +H2↑得到P,可知,2HCOONa →Na2C2O4 + H2↑,P為Na2C2O4 ,C2O42- + Ca2+ = CaC2O4↓,依據Ksp(CaC2O4) = c(Ca2+)?c(C2O42-) = 2.3×10-9,可計算出當CaC2O4完全沉淀時,溶液中Ca2+的物質的量濃度至少為:c(Ca2+) =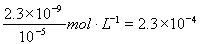 mol?L-1
mol?L-1
(6)實驗室Na2C2O4與足量HCl反應可得到H2C2O4 ,H2C2O4在濃硫酸條件下共熱分解生成CO、CO2、H2O ( 即 H2C2O4  CO↑ + CO2↑+ H2O )。設計證明分解產物中存在還原性氣體CO的實驗為:將所得氣體先通過足量NaOH溶液(或通過盛有固體NaOH的干燥管),再通過澄清石灰水,若無現象,點燃剩余氣體,將事先用澄清石灰水潤濕過的燒杯倒置在火焰上方,燒杯內壁變渾濁,說明有還原性氣體CO的存在。
CO↑ + CO2↑+ H2O )。設計證明分解產物中存在還原性氣體CO的實驗為:將所得氣體先通過足量NaOH溶液(或通過盛有固體NaOH的干燥管),再通過澄清石灰水,若無現象,點燃剩余氣體,將事先用澄清石灰水潤濕過的燒杯倒置在火焰上方,燒杯內壁變渾濁,說明有還原性氣體CO的存在。
考點:物質結構、元素推斷、元素及化合物等知識


 學而優銜接教材南京大學出版社系列答案
學而優銜接教材南京大學出版社系列答案 小學課堂作業系列答案
小學課堂作業系列答案 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源:湖南省長郡中學2012屆高三第五次月考化學試題 題型:043
| |||||||||||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com