
A.HF、HCl、HBr、HI的熱穩定性依次減弱
B.Na、Mg、Al的硬度依次增大
C.NaF、NaCl、NaBr、NaI的熔點依次降低
D.F2、Cl2、Br2、I2的熔、沸點逐漸升高
科目:高中化學 來源: 題型:
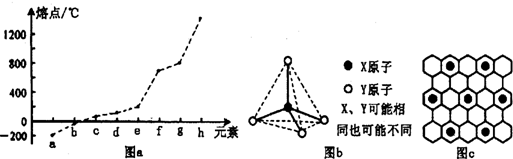
| 氫化物 | A | B | C | D | E |
| 沸點/℃ | 1317 | 100 | 19.5 | -33 | -162 |
查看答案和解析>>
科目:高中化學 來源: 題型:
元素周期表是學習物質結構和性質的重要工具,元素周期律反映了元素性質的周期性變化規律。
(1)元素A的原子最外層電子排布式為nsnnpn,該原子最外層共有 種不同運動狀態的電子,該原子核外共有 種能量不同的電子。元素A與氫元素形成的分子,其空間結構可能是(填序號) 。
(2)下列變化規律中正確的是 。
A.金屬K、Na、Mg的熔沸點由低到高
B.C1-、Br-、I-的失電子能力由弱到強
C.H+、Li+、H-的半徑由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到強
(3)第二周期元素中,除Be、B、Ne三種元素外,其他元素的氫化物沸點如下表所示,其中A的電子式為 ,E的化學式為 。
| 氫化物 | A | B | HF | D | E |
| 沸點/℃ | 1317 | 100 | 19.5 | 33 | 164 |
查看答案和解析>>
科目:高中化學 來源:2010-2011學年上海市閘北區高三上學期期末考試化學試卷 題型:填空題
元素周期表是學習物質結構和性質的重要工具,元素周期律反映了元素性質的周期性變化規律。
(1)元素A的原子最外層電子排布式為nsnnpn,該原子最外層共有 種不同運動狀態的電子,該原子核外共有 種能量不同的電子。元素A與氫元素形成的分子,其空間結構可能是(填序號) 。
(2)下列變化規律中正確的是 。
A.金屬K、Na、Mg的熔沸點由低到高
B.C1-、Br-、I-的失電子能力由弱到強
C.H+、Li+、H-的半徑由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到強
(3)第二周期元素中,除Be、B、Ne三種元素外,其他元素的氫化物沸點如下表所示,其中A的電子式為 ,E的化學式為 。
|
氫化物 |
A |
B |
HF |
D |
E |
|
沸點/℃ |
1317 |
100 |
19.5 |
33 |
164 |
查看答案和解析>>
科目:高中化學 來源:2010年重慶巫山高級中學高三上學期開學考試化學試題 題型:填空題
元素周期表反映了元素性質的周期性變化規律。請根據短周期元素在周期表中的位置、結構和相關性質,回答下列問題:
(1)第VIA族元素形成的氫化物中沸點最高的是____________(用分子式表示),原因是____________________,該分子的空間構型為______________。
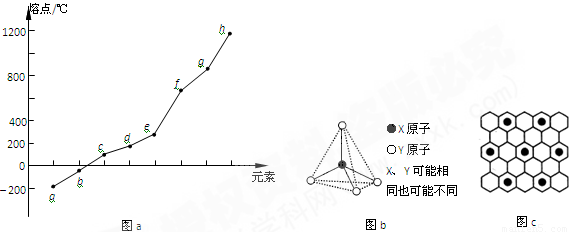
(2)第二周期元素中,除Be、B、Ne三種元素外,其他元素的氫化物沸點如表1所示,其中E的化學式為 ;第三周期元素單質的熔點(℃)變化如圖a所示,其中h的元素符號為 。 (表1)
|
氫化物 |
A |
B |
HF |
D |
E |
|
沸點/℃ |
1317 |
100 |
19.5 |
33.35 |
164 |
(3)第二、第三周期的某些元素能形成單質甲和化合物乙,它們具有圖b所示的結構單元,甲和乙的晶體類型相同,甲的某種同素異形體與乙在高溫時能發生置換反應生成h的單質和CO。若該反應生成的h的單質含有1 mol共價鍵,則參加反應的乙的質量為_______________g。
(4)碳元素的某種單質具有平面層狀結構,該單質的名稱為__________;同一層中的原子構成許多的正六邊形,單質與熔融的鉀相互作用,形成某種青銅色的物質(其中的元素鉀用“●”表示),原子分布如圖c所示,該物質的化學式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com