
| A. | 乙元素的族序數比甲元素的族序數大 | |
| B. | 甲、丙元素最高價氧化物對應水化物的酸性強弱順序:甲>丙 | |
| C. | 原子半徑由大到小的順序:丙>甲>乙 | |
| D. | 含乙元素的化合物數目比含甲或丙元素的化合物數目多 |
分析 甲、乙、丙都是短周期元素,其中甲、乙兩元素原子的最外層電子數分別是次外層電子數的2倍和3倍,則甲、乙都有2個電子層,甲元素原子的最外層電子數是2×2=4,故甲為C元素,乙元素原子的最外層電子數為2×3=6,故乙為O元素,丙元素原子K層和M層電子數之和與L層的電子數相同,則M層電子數為8-2=6,故丙為S元素,據此解答.
解答 解:甲、乙、丙都是短周期元素,其中甲、乙兩元素原子的最外層電子數分別是次外層電子數的2倍和3倍,則甲、乙都有2個電子層,甲元素原子的最外層電子數是2×2=4,故甲為C元素,乙元素原子的最外層電子數為2×3=6,故乙為O元素,丙元素原子K層和M層電子數之和與L層的電子數相同,則M層電子數為8-2=6,故丙為S元素.
A.乙為O,原子序數為8,處于第二周ⅥA,甲為C,原子序數為6,處于第二周ⅣA族,則乙元素的族序數比甲元素的族序數大,故A正確;
B.甲為C,其最高價含氧酸為碳酸,屬于弱酸,丙為S,最高價含氧酸為硫酸,屬于強酸,故硫酸的酸性更強,故B錯誤;
C.C、O都位于第二周期,同周期元素的原子序數越大,原子半徑越小,則原子半徑C>O,電子層越多原子半徑越大,故原子半徑S>C>O,故C正確;
D.甲為C元素,C元素可形成有機物,種類繁多,比O、S形成的化合物的種類多,故D錯誤.
故選:BD.
點評 本題考查原子結構與元素周期律的應用,題目難度不大,注意把握核外電子排布規律與元素周期表的結構.


科目:高中化學 來源: 題型:選擇題
| W | X | R | |
| Y | Z |
| A. | 粒子半徑:原子半徑最大的是W,簡單陰離子半徑最小的是R | |
| B. | 單質:氧化性最強的是Z,還原性最強的是Y | |
| C. | 最高價氧化物對應水化物:酸性最強的是Z,水溶性最差的是Y | |
| D. | 最簡單氫化物:沸點最高的是X,穩定性最差的是W |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KMnO4溶液 | B. | H2O2溶液 | C. | 氯水 | D. | HNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
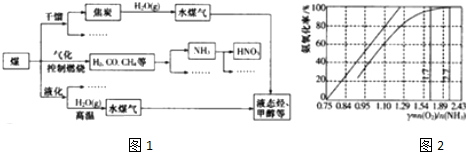
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解、電鍍、電化學腐蝕都需要通電才可進行 | |
| B. | Al、Fe、Cu三者對應的氧化物均為堿性氧化物 | |
| C. | 濃H2SO4和新制氯水分別滴在pH試紙上均會出現先變紅后褪色的現象 | |
| D. | 氫氧化鋁可以中和過多的胃酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
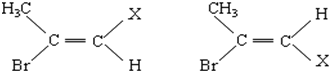
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com