
【題目】已知反應:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)。在一定壓強下,按
CH2=CHCH2Cl(g)+HCl(g)。在一定壓強下,按![]() 向密閉容器中充入氯氣與丙烯。圖甲表示平衡時,丙烯的體積分數(
向密閉容器中充入氯氣與丙烯。圖甲表示平衡時,丙烯的體積分數(![]() )與溫度(T)、
)與溫度(T)、![]() 的關系,圖乙表示反應的平衡常數K與溫度T的關系。則下列說法正確的是
的關系,圖乙表示反應的平衡常數K與溫度T的關系。則下列說法正確的是

A. 圖甲中![]()
B. 若在恒容絕熱裝置中進行上述反應,達到平衡時,裝置內的氣體壓強將不變
C. 溫度T1、![]() , Cl2的轉化率約為33.3%
, Cl2的轉化率約為33.3%
D. 圖乙中,線A表示正反應的平衡常數
【答案】C
【解析】
A.ω增大,CH2=CHCH3的轉化率增大,則φ減小,由上述分析可知:ω2>ω1,則ω1<1,故A錯誤;
B.該反應在反應前后氣體分子數不變,根據圖甲升高溫度丙烯的體積分數增大,即升高溫度平衡逆向移動,正反應放熱,在恒容絕熱裝置中進行題述反應,體系內溫度升高,根據PV=nRT,達到平衡時,裝置內的氣體壓強將增大,故B錯誤;
C.由圖乙可知,T1時平衡常數為1,設起始時CH2=CHCH3和Cl2的物質的量分別為amol和2amol,達到平衡時轉化的Cl2的物質的量為xmol,根據三段式進行計算:
CH2=CHCH3(g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)
起始(mol) a 2a 0 0
轉化(mol) x x x x
平衡(mol) a-x 2a-x x x
則(![]() )2÷(
)2÷(![]() ×
×![]() )=1,解得x=2/3a,則Cl2的轉化率2/3a÷2a×100%=33.3%,
)=1,解得x=2/3a,則Cl2的轉化率2/3a÷2a×100%=33.3%,
故C正確;
D.由圖甲可知,ω一定時,溫度升高,φ增大,說明正反應是放熱反應,故溫度升高,正反應平衡常數減小,故圖乙中,線A表示逆反應的平衡常數,故D錯誤。
故選C。


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:
【題目】硫酸亞鐵銨[(NH4)2Fe(SO4)2]是分析化學中的重要試劑,在不同溫度下加熱分解產物不同。設計如圖實驗裝置(夾持裝置略去),在500℃時隔絕空氣加熱A中的硫酸亞鐵銨至分解完全。確定分解產物的成分。

(1)B裝置的作用是__________。
(2)實驗中,觀察到C中無明顯現象,D中有白色沉淀生成,可確定產物中定有______氣體產生,寫出D中發生反應的離子方程式__________。若去掉C,是否能得出同樣結論并解釋其原因_____________。
(3)A中固體完全分解后變為紅宗色粉末,某同學設計實驗驗證固體殘留物僅為Fe2O3.而不含FeO。請完成表內容。(試劑,僅然和用品自選)
實驗步驟 | 預期現象 | 結論 |
取少量A中殘留物于試管中,加入適量稀硫酸,充分振蕩使其完全溶解:_________ | ___________ | 固體殘留物僅為Fe2O3 |
(4)E中收集到的氣體只有N2,其物質的量為xmol,固體殘留物剛體死目物Fe2O3的物質的量為ymol,D中沉淀物質的量為zmol,根據氧化還原反應的基本規律,x、y和z應滿足的關系為________。
(5)結合上述實驗現象和相關數據的分析。寫出硫酸亞鐵銨在500℃時隔絕空氣加熱完全分解的化學方程式:_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰氯是工業上重要的原料,是合成有機物的中間體。
2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0
2ClNO(g) △H<0
(1)在恒溫條件下,向2L恒容密閉容器中加入0.2molNO和0.1molCl2,10min時反應達到平衡。測得10min內v(ClNO)=7.5×10-3mol·L-1·min-1 ,則平衡后NO的轉化率α1=_____________。其它條件保持不變,反應在恒壓條件下進行,平衡時NO的轉化率α2________α1(填“>”“<”或“=”)。
(2)若使反應2NO(g)+Cl2(g)![]() 2ClNO(g) 的平衡常數增大,可采用的措施是___________。
2ClNO(g) 的平衡常數增大,可采用的措施是___________。
(3)將NO與Cl2按物質的量之比2∶1充入一絕熱密閉容器中,發生反應:2NO(g)+Cl2(g)![]() 2ClNO △H<0,實驗測得NO的轉化率α(NO)隨時間的變化經如圖所示。NO(g)的轉化率α(NO)在t2~t3時間段內降低的原因是______________________________。
2ClNO △H<0,實驗測得NO的轉化率α(NO)隨時間的變化經如圖所示。NO(g)的轉化率α(NO)在t2~t3時間段內降低的原因是______________________________。

(4)在其他條件相同時,向五個恒溫的密閉容器中分別充入1molCl2與2molNO,發生反應:2NO(g)+Cl2(g)![]() 2ClNO(g) △H< 0,部分反應條件及平衡時ClNO的含量如下表所示:
2ClNO(g) △H< 0,部分反應條件及平衡時ClNO的含量如下表所示:
容器編號 | 溫度/℃ | 容器體積/L | 平衡時ClNO含量(占比) |
Ⅰ | T1 | 2 | 2/3 |
Ⅱ | T2=T1 | 3 | W2 |
Ⅲ | T3>T1 | V3 | 2/3 |
Ⅳ | T4 | V4 | W4 |
Ⅴ | T5 | V5 | W5 |
①V3________2 (填寫“大于”、“小于”或“等于”);
②容器Ⅱ中化學平衡常數K=_________;
③容器Ⅳ、容器Ⅴ分別與容器Ⅰ相比實驗條件不同,反應體系總壓強隨時間的變化如圖所示。與容器Ⅰ相比,容器Ⅳ改變的實驗條件是_____________________;容器Ⅴ與容器Ⅰ的體積不同,則容器Ⅴ中反應達到平衡時氣體總壓強(P )的范圍是________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨為重要化工原料,有廣泛用途。
(1)合成氨中的氫氣可由下列反應制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4KJ/mol
CO(g)+3H2(g) △H=+216.4KJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
則反應CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=______。
CO2(g)+4H2(g) △H=______。
(2)起始時投入氮氣和氫氣分別為1mol、3mol,在不同溫度和壓強下合成氨。平衡時混合物中氨的體積分數與溫度關系如圖。

①恒壓時,反應一定達到平衡狀態的標志是______(填序號):
A.N2和H2的轉化率相等 B.反應體系密度保持不變
C.![]() 的比值為3:2 D.
的比值為3:2 D.![]() =2
=2
②P1______P2(填“>”、“<”、“=”,下同):反應平衡常數:B點______D點;
③C點H2的轉化率______;(數值保留0.1%)在A、B兩點條件下,該反應從開始到平衡時生成氫氣平均速率:v(A)______v(B)(填“>”、“<”、“=”)。
(3)已知25℃時由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,則該混合溶液中各離子濃度的大小順序為______________(已知25℃時,H2SO3的電離平衡常數Ka1=1×10-2,Ka2=1×10-7)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 用犧牲陽極的陰極保護法保護船舶時,將船舶與石墨相連
B. 往含硫酸的淀粉水解液中,先加氫氧化鈉溶液,再加碘水,檢驗淀粉是否水解完全
C. 反應3Si(s)+2N2(g)=Si3N4(s)能自發進行,則該反應的△H<0
D. 已知BaSO4的Ksp= (Ba2+ )·c(SO42-),所以BaSO4在硫酸鈉溶液中溶解達到飽和時有c(Ba2+)=c(SO42-)=![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NO2是大氣污染物,但只要合理利用也是重要的資源。回答下列問題:
(1)NO2可以被NaOH溶液捕獲生成兩種鈉鹽,溶液呈堿性,寫出反應的化學方程式______________,已知常溫下,HNO2的電離平衡常數為Ka=5.0×10-4,則0.1mo/L NaNO2中c(OH-)=_____________(已知![]() )
)
(2)2NO(g)+O2(g)![]() 2NO2(g)的反應歷程分兩步,反應情況如下表:
2NO2(g)的反應歷程分兩步,反應情況如下表:
反應 | 速率表達式 | 反應熱 |
反應I:2NO(g) |
| △H1<0 |
反應II:N2O2(g)+O2(g) |
| △H2<0 |
反應2NO(g)+O2(g) ![]() 2NO2(g)的△H______(用△H1、△H2表示)。一定溫度下,反應2NO(g)+O2(g)
2NO2(g)的△H______(用△H1、△H2表示)。一定溫度下,反應2NO(g)+O2(g)![]() 2NO2(g)達到平衡狀態,若升高溫度,K將____(填“增大”、“減小”或“不變”),平衡常數的表達式K=____(用
2NO2(g)達到平衡狀態,若升高溫度,K將____(填“增大”、“減小”或“不變”),平衡常數的表達式K=____(用![]() 、
、![]() 、
、![]() 、
、![]() 表示)
表示)
(3)反應N2O4(g) ![]() 2NO2(g),在一定條件下N2O4與NO2的消耗速率與自身壓強關系為:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定條件下N2O4與NO2的消耗速率與自身壓強關系為:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中![]() 、
、![]() 是與溫度有關的常數。一定溫度下,相應的速率與壓強關系如圖所示,在圖中標出的點中,能表示該反應達到平衡狀態對應的兩個點是___________
是與溫度有關的常數。一定溫度下,相應的速率與壓強關系如圖所示,在圖中標出的點中,能表示該反應達到平衡狀態對應的兩個點是___________
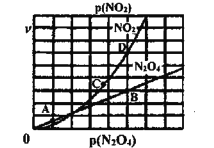
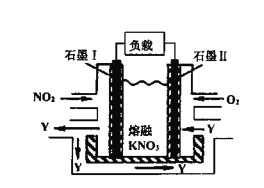
(4)NO2、O2和熔融KNO3可制作燃料電池,其原理如圖,該電池在使用過程中石墨I電極上生成氧化物Y,Y可循環使用。Y的化學式為____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,體積固定的密閉容器中發生可逆反應4HCl(g)+O2(g)=2H2O(g)+2Cl2(g)下列能說明反應已經達到平衡狀態的是( )
A.混合氣體的密度保持不變
B.混合氣體的平均相對分子質量保持不變
C.斷開4molH﹣Cl鍵的同時,生成4molH﹣O鍵
D.HCl、O2、H2O、Cl2四種氣體的物質的量之比為4:1:2:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生為了探究鋅與鹽酸反應過程中的速率變化,他在100mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(表中氣體體積為累計值,且已轉化為標準狀況):
時間(min) | 1 | 2 | 3 | 4 | 5 |
氫氣體積(mL) | 50 | 120 | 232 | 290 | 310 |
①哪一時間段(指0~1、1~2、2~3、3~4、4~5min)反應速率最大_____min,原因是_________________.
②哪一段時段的反應速率最小_____min,原因是_____________.
③求2~3分鐘時間段以鹽酸的濃度變化來表示的該反應速率_____________(設溶液體積不變)
④如果反應太激烈,為了減緩反應速率而又不減少產生氫氣的量,他在鹽酸中分別加入等體積的下列溶液:
A.蒸餾水;B.NaCl溶液;C.NaNO3溶液;D.CuSO4溶液;E.Na2CO3溶液,你認為可行的是_____.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語書寫正確的是( )
A. 鐵粉投入到NaHSO4溶液中的離子方程式:Fe+2HSO4—=Fe2++H2↑+ 2SO42—
B. HS-的電離方程式: HS-+H2O=== H3O++S2-
C. 液氨也可像水一樣發生自偶電離:2NH3![]() NH4++NH2—
NH4++NH2—
D. 雙氧水具有弱酸性,其電離方程式: H2O2![]() 2H++O22-
2H++O22-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com