
【題目】根據要求完成下列實驗。(a、b 為彈簧夾,其他裝置略去)
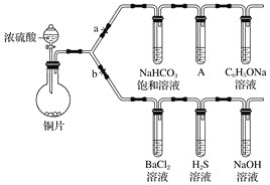
(一)驗證酸性的相對強弱:碳酸>苯酚。(已知酸性:亞硫酸 >碳酸)
(1)銅與濃硫酸反應的化學方程式是________________________________,裝置A中的足量的試劑是______________。
(2)連接儀器、________、加藥品后,打開a關閉 b,然后滴入濃硫酸,加熱。能說明碳酸的酸性比苯酚酸性強的實驗現象是:________________。
(二)驗證SO2具有氧化性、還原性和酸性氧化物的通性。
(3)打開b,關閉a。能驗證SO2具有氧化性的化學方程式是________________。
(4)若過量的SO2通入NaOH溶液中,其化學方程式是:________________。
(5)BaCl2溶液中無任何現象,將其分成兩份,分別滴加氨水和氯水,均產生白色沉淀,沉淀化學式分別是________________,________________。
(6)寫出其中SO2顯示還原性并生成白色沉淀的總的離子方程式________________________。
【答案】Cu+2H2SO4(濃)![]() CuSO4+SO2↑+2H2O酸性高錳酸鉀溶液或品紅溶液檢驗裝置的氣密性A中的酸性高錳酸鉀溶液(或品紅溶液)不褪色,苯酚鈉溶液變渾濁2H2S+SO2===3S↓+2H2OSO2+NaOH===NaHCO3BaSO3BaSO4Ba2++SO2+Cl2+2H2O===BaSO4↓+4H++2Cl-
CuSO4+SO2↑+2H2O酸性高錳酸鉀溶液或品紅溶液檢驗裝置的氣密性A中的酸性高錳酸鉀溶液(或品紅溶液)不褪色,苯酚鈉溶液變渾濁2H2S+SO2===3S↓+2H2OSO2+NaOH===NaHCO3BaSO3BaSO4Ba2++SO2+Cl2+2H2O===BaSO4↓+4H++2Cl-
【解析】
(一)(1)銅與濃硫酸反應,銅被氧化成+2價的銅離子,硫酸被還原成+4價的二氧化硫;利用高錳酸鉀溶液或品紅檢驗二氧化硫氣體;
(2)根據實驗程序:連接裝置、檢驗氣密性、加藥品來回答;當A中高錳酸鉀溶液沒有完全褪色,說明二氧化硫已經完全除盡,盛有苯酚鈉溶液的試管中出現渾濁,能說明碳酸的酸性比苯酚酸性強;
(二)(3)二氧化硫中硫元素的化合價是+4價,被硫化氫中-2價的硫還原;
(4)過量的二氧化硫和氫氧化鈉反應生成亞硫酸氫鈉和水;
(5)氯氣分子具有氧化性,能把二氧化硫氧化成+6價的硫酸根離子,氨水能和二氧化硫的水溶液反應生成亞硫酸銨,該鹽可以和氯化鋇反應生成亞硫酸鋇沉淀,據此回答;
(6)二氧化硫通入BaCl2溶液中,滴加氯水溶液,氯水中有氯氣分子,氯氣分子具有氧化性,能把二氧化硫氧化成+6價的硫酸根離子,硫酸根離子和鋇離子反應生成硫酸鋇白色沉淀,據此書寫離子方程式。
(一)(1)銅和熱的濃硫酸反應,反應中Cu元素的化合價由0升高到+2價,作還原劑,產物為二氧化硫、硫酸銅和水;反應方程式為:2H2SO4(濃)![]() CuSO4+SO2↑+2H2O;裝置A是檢驗二氧化硫氣體是否被碳酸氫鈉溶液吸收完全,因此可以用高錳酸鉀溶液或品紅溶液,只要溶液不褪色或不完全褪色,證明二氧化硫氣體被吸收完全;因此,本題正確答案是:2H2SO4(濃)
CuSO4+SO2↑+2H2O;裝置A是檢驗二氧化硫氣體是否被碳酸氫鈉溶液吸收完全,因此可以用高錳酸鉀溶液或品紅溶液,只要溶液不褪色或不完全褪色,證明二氧化硫氣體被吸收完全;因此,本題正確答案是:2H2SO4(濃)![]() CuSO4+SO2↑+2H2O ;酸性高錳酸鉀溶液或品紅溶液。
CuSO4+SO2↑+2H2O ;酸性高錳酸鉀溶液或品紅溶液。
(2) 實驗程序:連接裝置、檢驗氣密性、加藥品,飽和碳酸氫鈉可以和二氧化硫氣體反應生成二氧化碳氣體,當A中高錳酸鉀溶液沒有完全褪色,說明二氧化硫已經完全除盡,避免了二氧化硫和可溶性苯酚鈉反應,二氧化碳和水反應生成碳酸,碳酸和可溶性苯酚鈉溶液反應生成油狀物苯酚,溶液變渾濁,從而說明碳酸能制取苯酚,能證明碳酸酸性強于苯酚的酸性;綜上所述,本題答案是:檢驗裝置的氣密性,A中的酸性高錳酸鉀溶液(或品紅溶液)不褪色,苯酚鈉溶液變渾濁;
(二) (3) 二氧化硫中硫元素的化合價是+4價,有氧化性,二氧化硫氣體與H2S 溶液常溫下反應,生成黃色固體硫(單質)和水,方程式為:2H2S+SO2===3S↓+2H2O;此反應可以證明二氧化硫的氧化性,因此,本題正確答案是: 2H2S+SO2===3S↓+2H2O。
(4)若過量的SO2通入NaOH溶液中,反應生成亞硫酸氫鈉,化學方程式是:SO2+NaOH===NaHSO3;綜上所述,本題答案是:SO2+NaOH===NaHSO3。
(5) 將二氧化硫通入BaCl2溶液中,滴加氯水溶液,氯水中有氯氣分子,氯氣分子具有氧化性,能把二氧化硫氧化成+6價的硫酸根離子,硫酸根離子和鋇離子反應生成硫酸鋇白色沉淀;另一份中滴加氨水,二氧化硫和水生成亞硫酸,亞硫酸和氨水反應生成亞硫酸銨,亞硫酸銨電離出氨根離子和亞硫酸根離子,亞硫酸根離子和鋇離子反應生成亞硫酸鋇沉淀;綜上所述,本題答案是:BaSO3 ,BaSO4。
(6)將二氧化硫通入BaCl2溶液中,滴加氯水溶液,氯水中有氯氣分子,氯氣分子具有氧化性,能把二氧化硫氧化成+6價的硫酸根離子,硫酸根離子和鋇離子反應生成硫酸鋇白色沉淀,總反應為:Ba2++SO2+Cl2+2H2O===BaSO4↓+4H++2Cl-;綜上所述,本題答案是:Ba2++SO2+Cl2+2H2O===BaSO4↓+4H++2Cl-。


科目:高中化學 來源: 題型:
【題目】為了除去氯化鈉溶液中的少量溴化鈉,常用方法是往溶液中加入少量氯水,發生反應:2NaBr+Cl2===2NaCl+Br2,然后加入苯或四氯化碳,經振蕩、靜置、分液,可得到氯化鈉溶液。下列分析判斷中不正確的是( )
A.加入苯或四氯化碳的操作叫萃取
B.苯層在上層或四氯化碳層在下層
C.可以用酒精代替苯或四氯化碳
D.氯單質置換了溴單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示原電池工作時,右池中Y2O72-轉化為Y3+。下列敘述正確的是( )

A. 左池電極反應式:X4+ + 2e- = X2+
B. 每消耗1mol Y2O72-,轉移3mol電子
C. 左池中陰離子數目增加
D. 鹽橋中陰離子移向右池
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四種離子,向其中逐漸加入鐵粉,溶液中Fe2+的濃度和加入鐵粉的質量的關系如圖所示,若整個反應過程中溶液的體積不發生變化,則下列說法中不正確的是

A. 原溶液的c(H+)=4mol·L—1
B. 若a=3,則原溶液中c(Cu2+)=1mol·L—1
C. 原溶液中的c(NO3-)=7mol·L-1
D. BC段發生反應的離子方程式為Cu2++Fe=Fe2++Cu
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將等物質的量的A、B混合于2L的密閉容器中,發生如下反應:3A(g)+B(g)![]() xC(g)+2D(g),經5min后,測得D的濃度為0.5mol/L,c(A):c(B)=3:5,C的平均反應速率為0.1 mol/(Lmin),試求:(1)x的值_______;
xC(g)+2D(g),經5min后,測得D的濃度為0.5mol/L,c(A):c(B)=3:5,C的平均反應速率為0.1 mol/(Lmin),試求:(1)x的值_______;
(2)5min時A的濃度_______;
(3)此5min內B的轉化率_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.下面是7×18的格子,按要求作答。

(1)用封閉的實線繪出元素周期表的輪廓。_______________
(2)“大爆炸理論”指出:200億年以前,宇宙中所有物質都包含在一個密度無限大、溫度無限高的原始核中,由于某種原因它發生了爆炸,首先產生了中子、質子和電子,隨后就產生了元素,已知這種元素的一種核素沒有中子。你由此可知最先產生的元素是________ (填寫元素名稱),該元素的另一種核素,其中子數比質子數多1,此種核素的原子符號是________。
(3)C、D、E、F的簡單離子半徑由小到大的順序是____________(填寫離子符號)。
(4)請用電子式表示出E和H組成的化合物的形成過程:_________________。
(5)用實線繪出金屬與非金屬的分界線;用實線繪出過渡元素的分界線。_____________
(6)請寫出B形成的單質與氫氣反應的化學方程式:______________。
(7)下列各種敘述中,正確的是__________。
a.化學鍵可分為離子鍵、共價鍵、極性鍵和非極性鍵四種類型
b.由非金屬元素組成的化合物不一定是共價化合物
c.非極性鍵只存在于雙原子單質分子里
d.在Na2S溶液中加入氯水,溶液中出現黃色沉淀,可以說明氯元素的非金屬性比硫元素強
e.鹵素氟、氯、溴、碘的氫化物的沸點由低到高的順序為:HF<HCl<HBr<HI
f.構成單質分子的粒子不一定含有共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用濃氯化銨溶液處理過的舞臺幕布不易著火。其原因是 ( )
①幕布的著火點升高 ②幕布的質量增加
③氯化銨分解吸收熱量,降低了溫度 ④氯化銨分解產生的氣體隔絕了空氣
A.①②B.③④C.①③D.②④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com