
 某銨態氮肥由W、X、Y、Z 4種短周期元素組成,其中W的原子半徑最小.
某銨態氮肥由W、X、Y、Z 4種短周期元素組成,其中W的原子半徑最小. ;
; ;
;分析 某銨態氮肥由W、X、Y、Z等4種短周期元素組成,該銨鹽中一定含有N、H元素,且W的原子半徑最小,則W為H元素.
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物質之一,則ZY2為SO2,Y為O、Z為S元素,故X為N元素:
(1)X、Y、Z分別為N、O、S元素,分別處于第二周期ⅤA族、第二周期ⅥA族、第三周期ⅥA族;
(2)①N2H4分子中N原子之間形成1對共用電子對,N原子與H原子之間形成1對共用電子對;
②NH5為NH4H,由銨根離子與氫負離子構成;
③發生反應:4NH3+3O2═2N2+6H2O,計算4mol氨氣反應放出的熱量,注明物質聚集狀態與反應熱,書寫熱化學方程式;
Ⅱ.若Z是形成化合物種類最多的元素,則Z為C元素,
(4)該氮肥為碳酸銨或碳酸氫銨;
(5)a點時兩種物質恰好完全反應,則c(HR)=$\frac{0.02L×0.25mol/L}{0.025L}$=0.2 mol/L,而HR溶液的pH=3,則HR為弱酸,NaR為強堿弱酸鹽,溶液呈堿性,結合電荷守恒可知:c(R-)+c(OH-)-c(H+)=c(Na+);
②0.2 mol/L HR溶液中c(H+)=1.0×10-3mol/L,溶液中c(R-)≈c(H+),c(HR)≈0.2mol/L,代入電離常數Ka=$\frac{c({H}^{+})•c({R}^{-})}{c(HR)}$計算.
解答 解:某銨態氮肥由W、X、Y、Z等4種短周期元素組成,該銨鹽中一定含有N、H元素,且W的原子半徑最小,則W為H元素,
Ⅰ.若Y、Z同主族,ZY2是形成酸雨的主要物質之一,則ZY2為SO2,Y為O、Z為S元素,故X為N元素,
(1)X、Y、Z分別為N、O、S元素,分別處于第二周期ⅤA族、第二周期ⅥA族、第三周期ⅥA族,在周期表位置為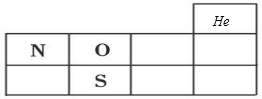 ,
,
故答案為: ;
;
(2)①N2H4分子中N原子之間形成1對共用電子對,N原子與H原子之間形成1對共用電子對,結構式為: ,
,
故答案為: ;
;
②NH5為NH4H,由銨根離子與氫負離子構成,電子式為 ,
,
故答案為: ;
;
③發生反應:4NH3+3O2═2N2+6H2O,4mol氨氣反應放出的熱量為382.8kJ×4=1531.2kJ,反應熱化學方程式為:4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1 ,
故答案為:4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=-1531.2 kJ•mol-1 ;
Ⅱ.若Z是形成化合物種類最多的元素,則Z為C元素:
(4)該氮肥為碳酸銨或碳酸氫銨,
故答案為:碳酸銨或碳酸氫銨;
(5)a點時兩種物質恰好完全反應,則c(HR)=$\frac{0.02L×0.25mol/L}{0.025L}$=0.2 mol/L,而HR溶液的pH=3,則HR為弱酸,NaR為強堿弱酸鹽,R-離子水解,溶液呈堿性,則pH>7,則c(Na+)>c(R-),水解程度微溶,溶液中離子濃度為:c(Na+)>c(R-)>c(OH-)>c(H+),結合電荷守恒可知:c(R-)+c(OH-)-c(H+)=c(Na+)=$\frac{0.02L×0.25mol/L}{0.045L}$≈0.11mol•L-1,故ab錯誤、c正確,
故答案為:>;c;
②0.2 mol/L HR溶液中c(H+)=1.0×10-3mol/L,溶液中c(R-)≈c(H+)=1.0×10-3mol/L,c(HR)≈0.2mol/L,電離常數Ka=$\frac{c({H}^{+})•c({R}^{-})}{c(HR)}$=$\frac{1×1{0}^{-3}×1×1{0}^{-3}}{0.2}$=5.0×10-6,
故答案為:5.0×10-6.
點評 本題位置、結構與性質關系的綜合應用,題目難度中等,涉及元素推斷、電子式、結構式、熱化學方程式、鹽類水解、電離平衡常數等知識,試題知識點較多、綜合性較強,側重考查考生對基本概念和基本原理的理解和應用能力.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
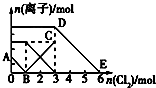 向含有Fe2+、I-、Br-的溶液中通入適量氯氣,溶液中各種離子的物質的量變化如圖所示.有關說法不正確的是( )
向含有Fe2+、I-、Br-的溶液中通入適量氯氣,溶液中各種離子的物質的量變化如圖所示.有關說法不正確的是( )| A. | 線段BC代表Fe3+物質的量的變化情況 | |
| B. | 原混合溶液中n(FeBr2)=3mol | |
| C. | 當通入2molCl2時,溶液中已發生的離子反應為:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 當金屬全部溶解時收集到NO氣體的體積一定為2.24 L | |
| B. | 當生成的沉淀量達到最大時,消耗NaOH溶液的體積V≥100mL | |
| C. | 參加反應的金屬的總質量3.6g<m<9.6 g | |
| D. | 當金屬全部溶解時,參加反應的硝酸的物質的量一定是0.4 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O,產物苯胺還原性強,易被氧化,則由甲苯合成對氨基苯甲酸的步驟合理的是( )
+3FeCl2+2H2O,產物苯胺還原性強,易被氧化,則由甲苯合成對氨基苯甲酸的步驟合理的是( )| A. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{還原硝基}{→}$對氨基苯甲酸 | |
| B. | 甲苯$\stackrel{氧化甲基}{→}$X$\stackrel{硝化}{→}$Y$\stackrel{還原硝基}{→}$對氨基苯甲酸 | |
| C. | 甲苯$\stackrel{還原}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{硝化}{→}$對氨基苯甲酸 | |
| D. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{還原硝基}{→}$Y$\stackrel{氧化甲基}{→}$對氨基苯甲酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲醇對水質會造成一定的污染,有一種電化學法可消除這種污染,其原理是通電后,將Co2+氧化成Co3+,然后以Co3+作氧化劑把水中的甲醇氧化成CO2而凈化.實驗室用如圖裝置模擬上述過程:
甲醇對水質會造成一定的污染,有一種電化學法可消除這種污染,其原理是通電后,將Co2+氧化成Co3+,然后以Co3+作氧化劑把水中的甲醇氧化成CO2而凈化.實驗室用如圖裝置模擬上述過程:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 二氧化碳是引起“溫室效應”的主要物質,節能減排,高效利用能源,能夠減少二氧化碳的排放.在一定溫度下的2L固定容積的密閉容器中,通入2molCO2和3mol H2,發生的反應為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示.
二氧化碳是引起“溫室效應”的主要物質,節能減排,高效利用能源,能夠減少二氧化碳的排放.在一定溫度下的2L固定容積的密閉容器中,通入2molCO2和3mol H2,發生的反應為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com