
| A. | 高溫下,0.2 mol Fe與足量水蒸氣反應,生成的H2分子數目為0.3NA | |
| B. | 3.2 g O2和O3的混合氣體中氧原子數為0.2NA | |
| C. | 標準狀況下,5.6 L CO2與足量Na2O2反應轉移的電子數為0.5NA | |
| D. | 過氧化鈉與水反應時,生成0.1mol氧氣轉移的電子數為0.1NA |
分析 A、鐵與水蒸氣反應生成四氧化三鐵,產物中鐵元素的平均化合價為$\frac{8}{3}$,根據電子守恒計算出生成氫氣的物質的量;
B、氧氣和臭氧均由氧原子構成;
C、求出二氧化碳的物質的量,然后根據過氧化鈉與二氧化碳反應時,當1mol二氧化碳參與反應時反應轉移1mol電子來分析;
D、用過氧化鈉制取氧氣,氧元素的價態由-1價變為0價.
解答 解:A.鐵在高溫下與水蒸氣反應生成四氧化三鐵,四氧化三鐵中鐵元素的化合價為$\frac{8}{3}$,0.2mol鐵完全反應失去電子數為:0.2mol×($\frac{8}{3}$-0)=$\frac{8}{15}$mol,根據電子守恒,生成氫氣的物質的量為:$\frac{\frac{8}{15}mol}{2}$=$\frac{4}{15}$mol,生成的H2分子數為$\frac{4}{15}$NA,故A錯誤;
B、氧氣和臭氧均由氧原子構成,故3.2g混合物中含有的氧原子的物質的量為n=$\frac{3.2g}{16g/mol}$=0.2mol,個數為0.2NA個,故B正確;
C、標況下5.6L二氧化碳的物質的量為0.25mol,而過氧化鈉與二氧化碳反應時,當1mol二氧化碳參與反應時反應轉移1mol電子,故當0.25mol二氧化碳反應時轉移0.25mol電子即0.25NA個,故C錯誤;
D、用過氧化鈉制取氧氣,氧元素的價態由-1價變為0價,故當生成0.1mol氧氣時轉移0.2mol電子即0.2NA個,故D錯誤.
故選B.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


科目:高中化學 來源: 題型:解答題
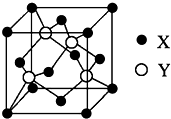 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表現出多種化合價,含ⅥA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表現出多種化合價,含ⅥA族元素的化合物在研究和生產中有許多重要用途.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
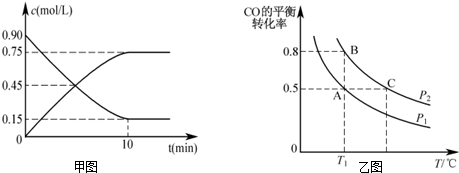
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
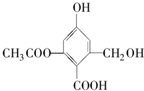
| A. | X的化學式為C10H10O6 | |
| B. | X在一定條件下能與FeCl3溶液發生顯色反應 | |
| C. | 1mol X分別與足量的Na、NaOH溶液、NaHCO3溶液反應,消耗這三種物質的物質的量分別為3mol、5mol、1mol | |
| D. | X既可以和乙醇又可以和乙酸發生酯化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.53g | B. | 5.30g | C. | 10.6g | D. | 11.7g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入一定量C,平衡逆向移動 | |
| B. | 保持溫度不變,容器容積壓縮到原來的一半,物質B的濃度變為原來的1.8倍,則平衡正向移動 | |
| C. | 恒溫恒壓,再充入1mol氦氣(不參與反應),A的轉化率增大,則m<n | |
| D. | 恒溫恒壓,再加入2mol的A,氣體的平均相對分子質量變為原來的2倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鑒別碳酸鈉和碳酸氫鈉溶液,用澄清石灰水 | |
| B. | 除去碳酸氫鈉溶液中的碳酸鈉,用稀鹽酸 | |
| C. | 除去MgCl2溶液中的FeCl3,加NaOH調pH | |
| D. | 檢驗FeCl2溶液中混有的FeCl3,可用NH4SCN溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
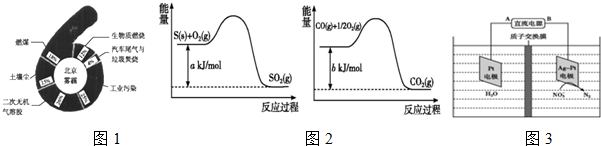
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 1 | 2 | 3 | 4 | 5 | 6 |
| CH4O | C2H4O2 | C4H8O2 | C5H12O | C6H12O2 |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com