
【題目】11P4+60CuSO4+96H2O = 20Cu3P+24H3PO4+60H2SO4中,1molCuSO4能氧化白磷(P4)的物質的量是
A.1/10molB.1/20molC.11/20molD.1/12mol
 學練快車道快樂假期寒假作業系列答案
學練快車道快樂假期寒假作業系列答案科目:高中化學 來源: 題型:
【題目】對于反應:![]() (Q>0),達到平衡后,改變一個條件,以下有關分析正確的是
(Q>0),達到平衡后,改變一個條件,以下有關分析正確的是
A.升高溫度,正反應速率增大,化學平衡常數增大
B.減小壓強,逆反應速率減小,化學平衡常數減小
C.加入催化劑,正逆反應速率不變,平衡不移動
D.充入氧氣,正反應速率先增大后減小,平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下是處于研究階段的“人工固氮”的新方法。N2在催化劑表面與水發生反應:2N2(g) +6H2O(l)![]() 4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
(1)該反應平衡常數的表達式K=______________。
(2)上述反應達到平衡后,保持其他條件不變,升高溫度,重新達到平衡時_______。
a. 平衡常數K增大 b. H2O的濃度減小
c. 容器內的壓強增大 d. v逆(O2)減小
(3)部分實驗數據見下表(條件:2 L容器、催化劑、光、N21 mol、水3 mol、反應時間3 h):
序號 | 第一組 | 第二組 | 第三組 | 第四組 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四組容器中3小時內以NH3表示的平均反應速率是______________。第四組容器內NH3生成量最小的可能原因是__________________。
(4)若用該反應進行工業生產,請選擇適宜的條件________________。(答兩條)
(5)工業合成氨時,合成塔中每產生1 mol NH3,放出46.1 kJ的熱量,則工業合成氨的熱化學方程式是_____________________。
(6)已知:N2(g)![]() 2N(g) H2(g)
2N(g) H2(g)![]() 2H(g),則斷開1 mol N-H鍵所需的能量是_______kJ。
2H(g),則斷開1 mol N-H鍵所需的能量是_______kJ。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設nA為阿伏伽德羅常數的數值,下列說法正確的是
A. 23g Na 與足量H2O反應完全后可生成nA個H2分子
B. 1 molCu和足量熱濃硫酸反應可生成nA個SO3分子
C. 標準狀況下,22.4L N2和H2混合氣中含nA個原子
D. 3mol單質Fe完全轉變為Fe3O4,失去8nA個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】50 mL 0.50 mol·L-1鹽酸與50 mL 0.55 mol·L-1 NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:

(1)從實驗裝置上看,圖中尚缺少的一種玻璃儀器是________。
(2)燒杯間填滿碎紙條的作用是________。
(3)大燒杯上如不蓋硬紙板,求得的中和熱數值____________(填“偏大”、“偏小”或“無影響”)。
(4)該實驗常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL進行實驗,其中NaOH溶液濃度大于鹽酸濃度的作用是______,當室溫低于10 ℃時進行實驗,對實驗結果會造成較大的誤差,其原因是_____________。
(5)實驗中改用60 mL 0.50 mol·L-1鹽酸與50 mL 0.50 mol·L-1 NaOH溶液進行反應,與上述實驗相比,所求得的中和熱________(填“相等”或“不相等”),簡述理由: ______________。
(6)用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱ΔH將________(填“偏大”、“偏小”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關實驗現象敘述錯誤的是( )
A.硫蒸汽與H2混合生成H2S
B.NH3使含酚酞的水溶液變紅,加熱后又恢復到無色
C.NH4Cl固體受熱會發生升華
D.濃硝酸久置后顏色會變黃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學反應能用離子反應:Ba2++2HCO3-+2OH-→BaCO3+CO32-+2H2O表示的是( )
A.Ba(OH)2與少量的NaHCO3
B.Ba(OH)2與少量的Ba(HCO3)2
C.Ba(HCO3)2與足量的NaOH
D.Ba(OH)2與足量的Ba(HCO3)2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫不正確的是
A.氫氧化鋁的酸式電離:Al(OH)3+H2O[Al(OH)4] —+H+
B.銅與稀硝酸的反應:Cu+4H++NO3—= Cu2+ + NO2+H2O
C.將去膜的鋁片投入到NaOH溶液中:2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
D.用碘化鉀淀粉溶液檢驗亞硝酸鈉中NO2—的存在:2NO2—+2I—+4H+=2NO↑+I2+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I .光氣(COCl2)在塑料、制革、制藥等工業上有許多用途。制備光氣的方法很多, 下列兩種方法常用。
(1)方法一:工業上制備光氣的原理:CO+Cl2![]() COCl2,其中原料氣CO可利用天然氣在氧氣中不完全燃燒生產,已知:
COCl2,其中原料氣CO可利用天然氣在氧氣中不完全燃燒生產,已知:
CH4(g)+2O2(g) =CO2(g)+2H2O(1) △H = - 890.3 kJ·mol-1
2CO(g)+O2(g)= 2CO2(g) △H =-566 kJ·mol-1
每生產224LCO (標準狀況)所放出的熱量約為________ kJ。
(2)方法二:實驗室可用氯仿(CHCl3)與雙氧水反應制備光氣,同時還有一種酸性溶液生成。寫出實驗室制備光氣的化學方程式__________。
II.COCl2 的分解反應為:COCl2(g)![]() Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反應體系達到平衡后,各物質的濃度在不同條件下的變化情況如下圖所示(第l0min到14 min的COCl2濃度變化曲線未畫出):
Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反應體系達到平衡后,各物質的濃度在不同條件下的變化情況如下圖所示(第l0min到14 min的COCl2濃度變化曲線未畫出):
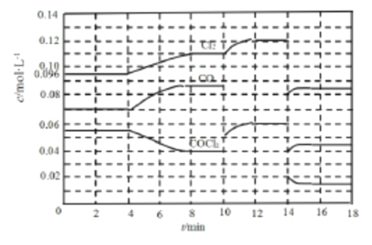
(3)先計算第8 min時CO的濃度,再計算平衡數K=________。
(4)比較第2 min反應溫度與第8 min反應溫度T8的高低:T2_____T8(選填“ >”、“< ”或“=”)。
(5)若12 min時反應于溫度T8下重新達到平衡,則此時c(COCl2)=_____mol·L-1(結果保留兩位小數)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com