
| 濕法 | 強堿性介質中,Fe(NO3)3與NaClO反應生成紫紅色高鐵酸鹽溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加熱共熔生成紫紅色高鐵酸鹽和KNO2等產物 |
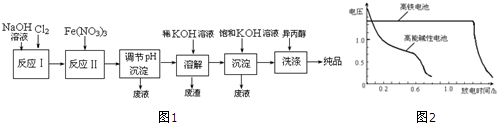
分析 反應Ⅰ:2NaOH+Cl2═NaCl+NaClO+H2O,反應Ⅱ:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,將Na2FeO4粗產品在40%KOH溶液中溶解,過濾除去雜質NaCl,加入飽和KOH溶液后,將Na2FeO4轉化為溶解度更小的K2FeO4,反應方程式為Na2FeO4+2KOH=K2FeO4+2NaOH,冷卻結晶,過濾,高鐵酸鉀易溶于水,難溶于異丙醇,用異丙醇代替水洗滌產品可以減少高鐵酸鉀的損耗,同時洗去高鐵酸鉀晶體表面的KOH和其它雜質,得到純產品高鐵酸鉀,
(1)①實驗室用濃鹽酸和二氧化錳在加熱條件下制取氯氣;
②反應I為氫氧化鈉和氯氣發生氧化還原反應生成NaCl、NaClO和水;
③次氯酸根離子和鐵離子、氫氧根離子發生氧化還原反應生成高鐵酸根離子、氯離子和水;
(2)高鐵酸鉀具有強氧化性,能殺菌消毒;反應生成的鐵離子水解生成的氫氧化鐵膠體,膠體具有吸附性,從而凈化水;
(3)根據含元素化合價升高的物質為還原劑,含元素化合價降低的物質為氧化劑,并利用化學反應方程式中的化學計量數來分析氧化劑與還原劑的物質的量之比;
(4)高鐵電池是可充電電池,其反應為3Zn+2K2FeO4+8H2O$?_{充電}^{放電}$3Zn(OH)2+2Fe(OH)3+4KOH,正極上高鐵離子得電子發生還原反應;陰極上氫氧化鋅得電子發生還原反應;
高鐵電池放電時間長,工作電壓穩定.
解答 解:反應Ⅰ:2NaOH+Cl2═NaCl+NaClO+H2O,反應Ⅱ:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,將Na2FeO4粗產品在40%KOH溶液中溶解,過濾除去雜質NaCl,加入飽和KOH溶液后,將Na2FeO4轉化為溶解度更小的K2FeO4,反應方程式為Na2FeO4+2KOH=K2FeO4+2NaOH,冷卻結晶,過濾,高鐵酸鉀易溶于水,難溶于異丙醇,用異丙醇代替水洗滌產品可以減少高鐵酸鉀的損耗,同時洗去高鐵酸鉀晶體表面的KOH和其它雜質,得到純產品高鐵酸鉀,
(1)①實驗室用濃鹽酸和二氧化錳在加熱條件下制取氯氣,反應方程式為MnO2+4HCl(濃鹽酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案為:MnO2+4HCl(濃鹽酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②反應I為氫氧化鈉和氯氣發生氧化還原反應生成NaCl、NaClO和水,反應方程式為2NaOH+Cl2=NaCl+NaClO+H2O,故答案為:2NaOH+Cl2=NaCl+NaClO+H2O;
③次氯酸根離子和鐵離子、氫氧根離子發生氧化還原反應生成高鐵酸根離子、氯離子和水,離子方程式為3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,故答案為:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
(2)高鐵酸鉀具有強氧化性,能殺菌消毒;反應生成的鐵離子水解生成的氫氧化鐵膠體,膠體具有吸附性,從而凈化水,
故答案為高鐵酸鉀有強氧化性,能殺菌消毒;產生的Fe(OH)3膠體有吸附性,能吸附水中懸浮物質形成沉淀,從而凈化水;
(3)Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,氮元素的化合價降低,鐵元素的化合價升高,則KNO3為氧化劑,Fe2O3為還原劑,氧化劑與還原劑的物質的量之比為3:1,故答案為:3:1;
(4)高鐵電池是可充電電池,其反應為3Zn+2K2FeO4+8H2O$?_{充電}^{放電}$3Zn(OH)2+2Fe(OH)3+4KOH,正極上高鐵離子得電子發生還原反應,電極反應式為FeO42-+4H2O+3e-=Fe(OH)3+5OH-;陰極上氫氧化鋅得電子發生還原反應,電極反應式為Zn(OH)2+2e-=Zn+2OH-;
高鐵電池放電時間長,工作電壓穩定,
故答案為:FeO42-+4H2O+3e-=Fe(OH)3+5OH-;Zn(OH)2+2e-=Zn+2OH-;放電時間長,工作電壓穩定.
點評 本題考查物質制備,為高頻考點,涉及原電池和電解池原理、氧化還原反應、氣體制備、鹽類水解等知識點,明確反應原理及物質性質是解本題關鍵,難點是電極反應式的書寫,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應過程中吸收大量的熱 | |
| B. | 反應前后原子個數不變 | |
| C. | 該反應屬于置換反應 | |
| D. | 參加反應的乙烯和氧氣的質量比為9:24 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com