
| A、②④③①⑤ | B、③②④①⑤ | C、②③①⑤④ | D、②④①⑤③ |
| ||


科目:高中化學 來源: 題型:
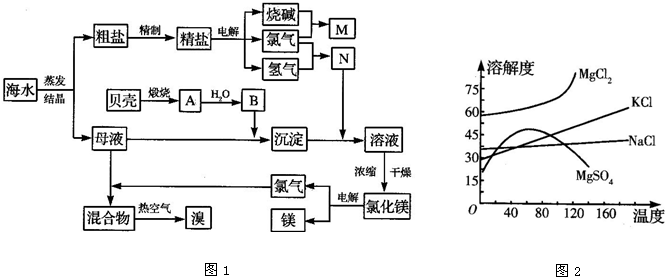
查看答案和解析>>
科目:高中化學 來源: 題型:
| 海水密度(g/mL) | CaSO4 (g/L) |
NaCl (g/L) |
MgCl2 (g/L) |
MgSO4 (g/L) |
NaBr (g/L) |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
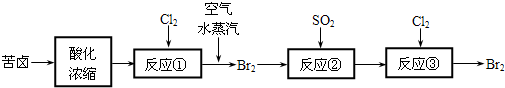
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com