
【題目】如圖為原電池裝置,下列敘述正確的是( )
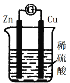
A.鋅片溶解
B.鋅片為正極
C.銅片質量減少
D.該裝置將電能轉化為化學能
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器內發生某氣體體系反應,根據如圖填空。
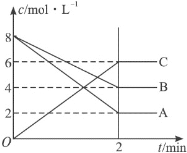
(1)反應物是___,生成物是____。
(2)在2min內A的平均反應速率為___mol·L-1·min-1。
(3)該反應的化學方程式是__![]() ___。
___。
(4)寫出此反應的平衡常數表達式___(用物質A、B、C表示),增大壓強,平衡向___(填“正”或“逆”)反應方向移動,K___(填“增大”、“減小”或“不變”)。
(5)轉化率為已反應的物質的量與初始物質的量比值,B的轉化率為___,若升高溫度,B的轉化率增加,則正反應是___(填“吸熱”或“放熱”)。
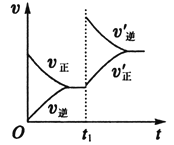
(6)2分鐘后的某時刻(t1)改變某一條件使平衡移動,符合如圖所示的條件是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關溶液中微粒濃度關系的敘述錯誤的是
A.![]()
![]() 溶液中:
溶液中:![]()
B.pH相等的①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 四種溶液的物質的量濃度大小:①>②>③>④
四種溶液的物質的量濃度大小:①>②>③>④
C.室溫下,![]() 的鹽酸與
的鹽酸與![]() 的氨水等體積混合得溶液中:
的氨水等體積混合得溶液中:![]()
D.向![]()
![]() 溶液中滴加NaOH至溶液恰好呈中性:
溶液中滴加NaOH至溶液恰好呈中性:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,Na2CO3 溶液存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列說法正確的是()
HCO3-+OH-。下列說法正確的是()
A.加入 NaOH 固體,溶液 pH 減小
B.稀釋溶液,水解平衡常數增大
C.升高溫度,![]() 減小
減小
D.加入 CaCl2 固體,平衡向逆反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將![]() mol
mol![]() 固體溶于水配成100mL溶液,向溶液中加入下列物質,有關結論正確的是
固體溶于水配成100mL溶液,向溶液中加入下列物質,有關結論正確的是
A.加入50mL1![]() ,反應結束后,
,反應結束后,![]()
B.加入![]() molCaO,溶液中
molCaO,溶液中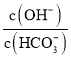 減小
減小
C.加入50mL![]() ,由水電離出的
,由水電離出的![]() 增大
增大
D.加入![]() mol
mol![]() 固體,反應完全后,溶液呈中性
固體,反應完全后,溶液呈中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是
A.銅投入濃硝酸中:Cu + 2NO![]() + 2H+ = Cu2+ + 2NO↑+ H2O
+ 2H+ = Cu2+ + 2NO↑+ H2O
B.氧化鋁投入稀鹽酸中:Al2O3 + 6H+ =2Al3+ + 3H2O
C.鈉和水反應:Na + H2O = Na+ + OH- + H2↑
D.用食醋溶解氫氧化鎂:Mg(OH)2+2H+=Mg2++2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,根據表中給出的10種元素,回答下列問題。
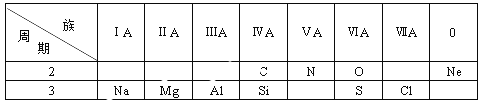
(1)金屬性最強的元素是___________;
(2)最外層電子數為8的原子是___________;
(3) O和S二者原子半徑較大的是___________;
(4)可用于制造光導纖維的氧化物是___________;
(5)CH4和SiH4二者熱穩定性較強的是___________;
(6)MgO和Al2O3中,能與強堿溶液反應的是_____________;
(7)NaOH和Mg(OH)2中,堿性較弱的是___________;
(8)NO在空氣中會變成紅棕色的NO2,寫出該反應的化學方程式___________;
(9)HClO4中氯元素的化合價是______;1mol HClO4含有_________mol O。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下圖回答:

(1)反應物是__________;.
(2)2min內A的平均速率是________;
(3)寫出化學方程式_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回收利用硫和氮的氧化物是保護環境的重要舉措。
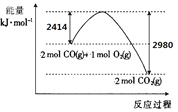
I.(1)工業生產可利用CO從燃煤煙氣中脫硫。
已知S(s)的燃燒熱(△H)為-mkJ/mol。CO與O2反應的能量變化如圖所示,則CO從燃煤煙氣中脫硫的熱化學方程式為______ (△H用含m的代數式表示) 。
(2)在模擬回收硫的實驗中,向某恒容密閉容器中通入2.8molCO和1molSO2氣體,反應在不同條件下進行,反應體系總壓強隨時間的變化如圖所示。
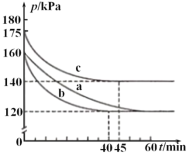
①與實驗a相比,實驗c改變的實驗條件可能是_________。
②請利用體積分數計算該條件下實驗b的平衡常數K=________。(列出計算式即可)(注:某物質的體積分數=該物質的物質的量/氣體的總物質的量)
(3)雙堿法除去SO2的原理為:NaOH溶液![]() Na2SO3溶液。該方法能高效除去SO2并獲得石膏。
Na2SO3溶液。該方法能高效除去SO2并獲得石膏。
①該過程中NaOH溶液的作用是_______。
②25℃時,將一定量的SO2通入到100mL0.1mol/L的NaOH溶液中,兩者完全反應得到含Na2SO3、NaHSO3的混合溶液,溶液恰好呈中性,則溶液中H2SO3的物質的量濃度是____(假設反應前后溶液體積不變;25℃時,H2SO3的電離常數 K1=1.0×10-2 K2=5.0×10-8)。
II.用NH3消除NO污染的反應原理為:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同溫度條件下,NH3與NO的物質的量之比分別為4:1、3:1、1:3,得到NO脫除率曲線如圖所示。
5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同溫度條件下,NH3與NO的物質的量之比分別為4:1、3:1、1:3,得到NO脫除率曲線如圖所示。
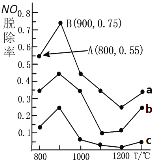
(1)曲線a中NH3的起始濃度為4×10-5mol/L,從A點到B點經過1秒,該時間段內NO的脫除速率為____mg/(L·s)。
(2)不論以何種比例混合,溫度超過900℃,NO脫除率驟然下降,除了在高溫條件下氮氣與氧氣發生反應生成NO,可能的原因還有(一條即可)____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com